
Über den Autor
Mohammed Jobran
Regulierungsberater (Apotheker BSc, Biomedizinische Informatik MSc). Mit 19 Jahren Erfahrung in der Arbeit für die SFDA, multinationale Unternehmen und als professioneller Berater.
Die saudische Lebensmittel- und Arzneimittelbehörde ( SFDA ) verlangt von Herstellern medizinischer Geräte, dass sie vor der Vermarktung ihrer Produkte einen autorisierten Vertreter (AR) in Saudi-Arabien benennen. Dieser AR ist als lokaler Vertreter für regulatorische Aktivitäten wie die Registrierung von Medizinprodukten und die Markteinführungsüberwachung verantwortlich.
Die Ernennung eines Bevollmächtigten erfordert die Einreichung einer unterzeichneten Vereinbarung bei der SFDA . Der Prozess ist schnell, und der Hersteller kann den Bevollmächtigten auf ähnliche Weise wechseln . Hier einige erste Hinweise:
- Die Ernennung eines AR ist ein 1-2-wöchiger Prozess.
- Eine Änderung der AR ist jederzeit möglich.
- Hersteller können (unter Auflagen) mehrere ARs ernennen.
- Vor der Geräteregistrierung und Vermarktung ist eine gültige AR-Lizenz erforderlich.
- Für die Versandabfertigung ist eine gültige AR-Lizenz erforderlich.
In diesem Beitrag geht es um die Rolle des AR und darum, wie Sie einen solchen für Ihr Unternehmen ernennen.
Inhaltsverzeichnis
Was ist ein Bevollmächtigter?
Ein autorisierter Vertreter ist das lokale saudische Unternehmen, das den internationalen Hersteller von Medizinprodukten in Saudi-Arabien rechtlich vertritt. SFDA verlangt von Unternehmen die Ernennung eines autorisierten Vertreters vor der Registrierung ihres Produkts. Dieser muss nicht zwangsläufig der Vertriebshändler sein.
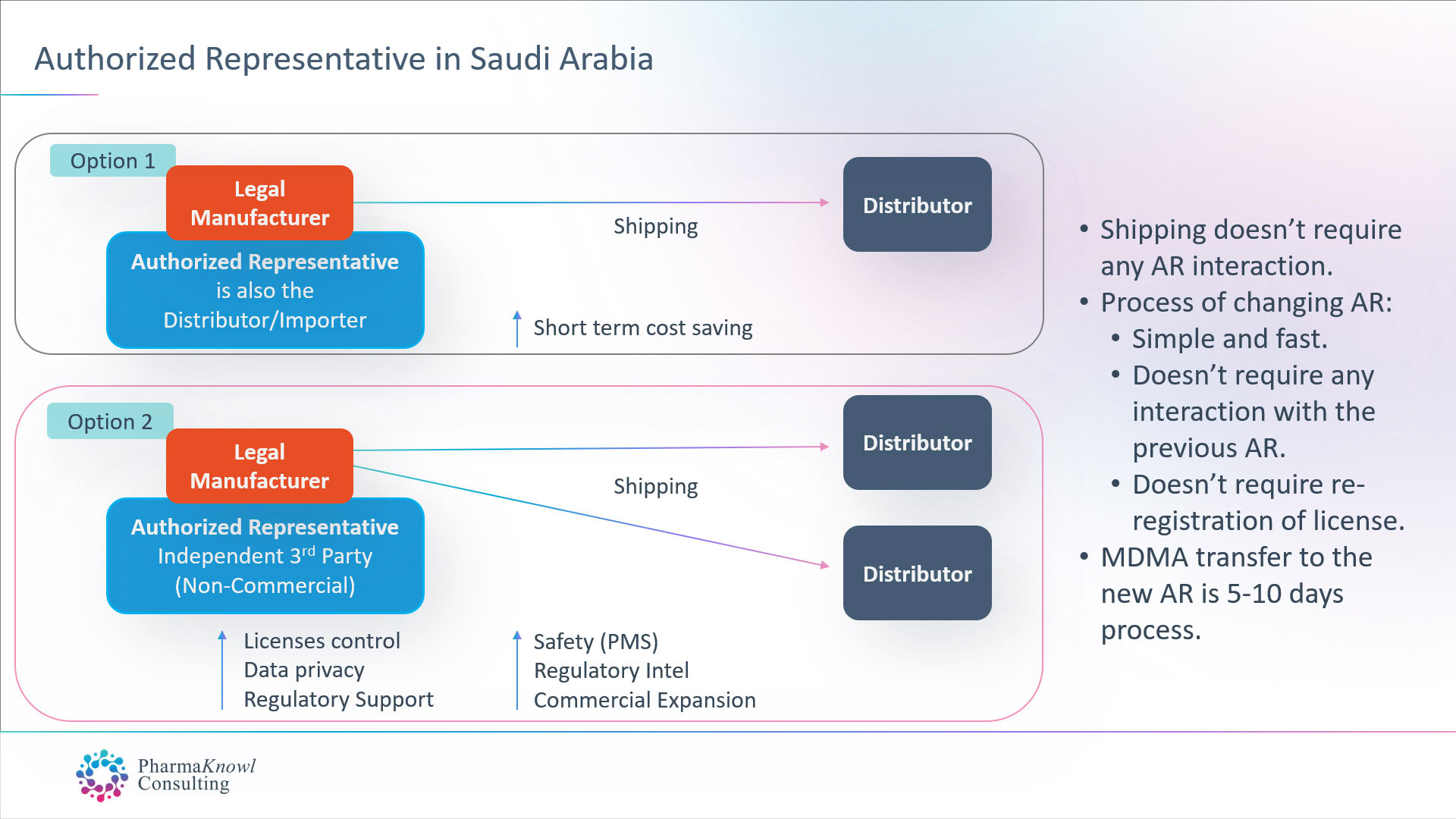
Unabhängiger AR vs. Distributor als AR
Internationale Hersteller medizinischer Geräte haben zwei Möglichkeiten, wenn sie einen AR in Saudi-Arabien ernennen möchten:
- Ernennen Sie ihren kommerziellen Vertriebshändler als ihren AR.
- Beauftragen Sie einen unabhängigen AR (nicht kommerziell).
Die meisten legalen Hersteller ziehen es vor, einen unabhängigen AR zu ernennen, da dies in Saudi-Arabien die beste Option ist, ähnlich der gängigen Praxis in der EU.
Unabhängige AR-Vorteile
Die Zahlung einer jährlichen Festgebühr für einen unabhängigen AR ohne Provision auf Sendungen bietet Herstellern eine Reihe von Vorteilen, wie zum Beispiel:
- Erweiterte regulatorische und Post-Marketing-Unterstützung.
- Möglichkeit, mehrere Markennamen für dasselbe Produkt zu registrieren.
- Möglichkeit, Waren an mehrere Händler/Importeure zu versenden.
- Stabiler Geschäftsbetrieb.
- Kontrolle über Produktlizenzen
- Vertraulichkeit der Daten.
- Unvoreingenommene Beratung und Markteinblicke.
- Rechtzeitige behördliche Informationen.
- Hohe Kommunikationsfähigkeiten.
Aufgaben
Der AR muss dem gesetzlichen Hersteller Folgendes zur Verfügung stellen:
- Rechtliche und autorisierte Vertretung bei SFDA
- Regulatorische Unterstützung
- Senden Sie die eindeutige Gerätekennung ( SFDA UDI )
- Klarstellung der SFDA -Vorschriften
- Marktinformationen und Einblicke
- MDMA-Updates
- Überwachung nach der Markteinführung
- Meldung unerwünschter Ereignisse und Vorfälle
- Einreichung von Korrekturmaßnahmen
- Führen Sie eine klinische Nachbeobachtung nach der Markteinführung (PMCF) in Saudi-Arabien durch
- Erleichtern Sie die Gerätewartung
- Support bei Problemen mit der Versandfreigabe
AR Standardqualitäten
- Hervorragende Abdeckung wesentlicher Aufgaben
Einhaltung gesetzlicher Vorschriften, Sicherheitsüberwachung, Kommunikationsfähigkeiten usw. - Regulierungsintelligenz:
Geben Sie regulatorische Aktualisierungen umgehend weiter und ermöglichen Sie die Identifizierung betroffener Bereiche und Risikostufen. - Guter Zugang zur SFDA
Zur Unterstützung und Problemlösung. - Funktionen zur Lieferkettenplanung
Beispielsweise für Ankunftspläne vs. Genehmigungsdaten und Einfuhrgenehmigungen - Arbeiten an E-Systemen der Hersteller
Zum Aktualisieren regulatorischer Meilensteine wie Registrierungsdaten, Ablaufdaten, Verlängerungen usw. - Unterstützen Sie SFDA Inspektionen
- Erleichtert den Papierkram im Hafen.
- Lösen Sie andere Probleme auf dem Markt.

Niedrigrisikoklassen
Bisher verlangte SFDA AR nur für Produkte mit hohem Risiko. Seit dem 27. September 2022 ist AR jedoch auch für Produkte mit geringem Risiko verpflichtend. Dies fiel mit der Aufhebung des Registrierungsverfahrens für Produkte mit geringem Risiko (MDNR) zusammen.
Lizenzanforderungen
Hier listen wir die Anforderungen SFDA auf, die ein lokales Unternehmen erfüllen muss, um als autorisierter Vertreter zu fungieren:
- Ein saudisches Unternehmen mit einem Handelsregister (CR) für die Tätigkeit im Bereich medizinischer Geräte.
- Verfügbarkeit eines Qualitätsmanagementsystems (QMS)
- Ein gültiges ISO 13485-Zertifikat .
- Bestehen SFDA -Inspektion
- Eine gültige SFDA -Lizenz zur Herstellung von Medizinprodukten (MDEL)
- Spezielles Personal für Sicherheits- und Regulierungsfunktionen.
- Unterzeichneter Autorisierungsvertrag mit dem rechtmäßigen Hersteller.
AR-Vereinbarung
Die SFDA schreibt eine spezielle AR-Vereinbarungsvorlage vor, die zwischen den legalen Herstellern und ihren autorisierten Vertretern in Saudi-Arabien unterzeichnet werden muss.
Hier einige wichtige Hinweise dazu:
- Hersteller können (unter Auflagen) mehrere ARs ernennen.
- Die AR-Vereinbarung muss mit einer Apostille oder Legalisierung versehen sein.
- Die Mindestgültigkeitsdauer der AR beträgt ein Jahr.
- Die Gültigkeit der AR entspricht der Vertragslaufzeit oder ist kürzer.
Wechsel Ihres Bevollmächtigten
Für den Wechsel des autorisierten Vertreters in Saudi-Arabien ist keine Genehmigung des vorherigen Bevollmächtigten erforderlich. Der Vorgang dauert eine Woche, gefolgt von der Übertragung der Medizinproduktelizenzen (MDMA). Daher ist nach der Übertragung des Bevollmächtigten keine erneute Registrierung der Produkte erforderlich.
Gebühren
Die SFDA Lizenzgebühr für ein Bevollmächtigtenzertifikat beträgt 2.600 SAR/Jahr (693,33 USD). Weitere Informationen zu SFDA -Gebühren finden Sie in unserem Artikel: SFDA -Gebühren .
Autorisierter Vertreteranbieter
PharmaKnowl ist ein SFDA zugelassener autorisierter Vertreter, dem namhafte Medizinprodukte- und MedTech-Unternehmen weltweit vertrauen. Benötigen Sie einen autorisierten Vertreter für Ihren ersten Markteintritt oder für die Übertragung eines bestehenden autorisierten Vertreters in Saudi- Arabien? Kontaktieren Sie uns für ein Angebot. Gerne können Sie auch einen Termin mit uns vereinbaren, um Ihre Fragen zu beantworten.
Mehr lesen
SFDA -Registrierung



