
Acerca del autor
Mohamed Jobran
Consultor Regulatorio (licenciatura en Farmacia, maestría en Informática Biomédica). Con 19 años de experiencia trabajando para SFDA, empresas multinacionales y como consultor profesional.
La Autoridad Saudí de Alimentos y Medicamentos ( SFDA ) exige que los fabricantes de dispositivos médicos designen un representante autorizado (RA) en Arabia Saudita antes de comercializar sus productos. El RA será el representante local responsable de las actividades regulatorias, como el registro de dispositivos médicos y la vigilancia poscomercialización.
Para designar un representante autorizado es necesario presentar un acuerdo firmado a la SFDA . Es un proceso rápido, y el fabricante puede cambiar al representante autorizado de forma similar. A continuación, se presentan algunas notas iniciales:
- Designar un AR es un proceso que toma de 1 a 2 semanas.
- Es posible cambiar el AR en cualquier momento.
- Los fabricantes pueden designar varios AR (con condiciones).
- Es necesaria una licencia AR válida antes de registrar y comercializar el dispositivo.
- Para el despacho de envío se requiere una licencia AR válida.
Esta publicación discutirá el rol de AR y cómo designar uno para su empresa.
Tabla de contenido
¿Qué es un representante autorizado?
El representante autorizado es la empresa saudí local que representa legalmente al fabricante internacional de dispositivos médicos en Arabia Saudita. SFDA exige que las empresas designen un representante autorizado antes de registrar su producto; este no es necesariamente el distribuidor.
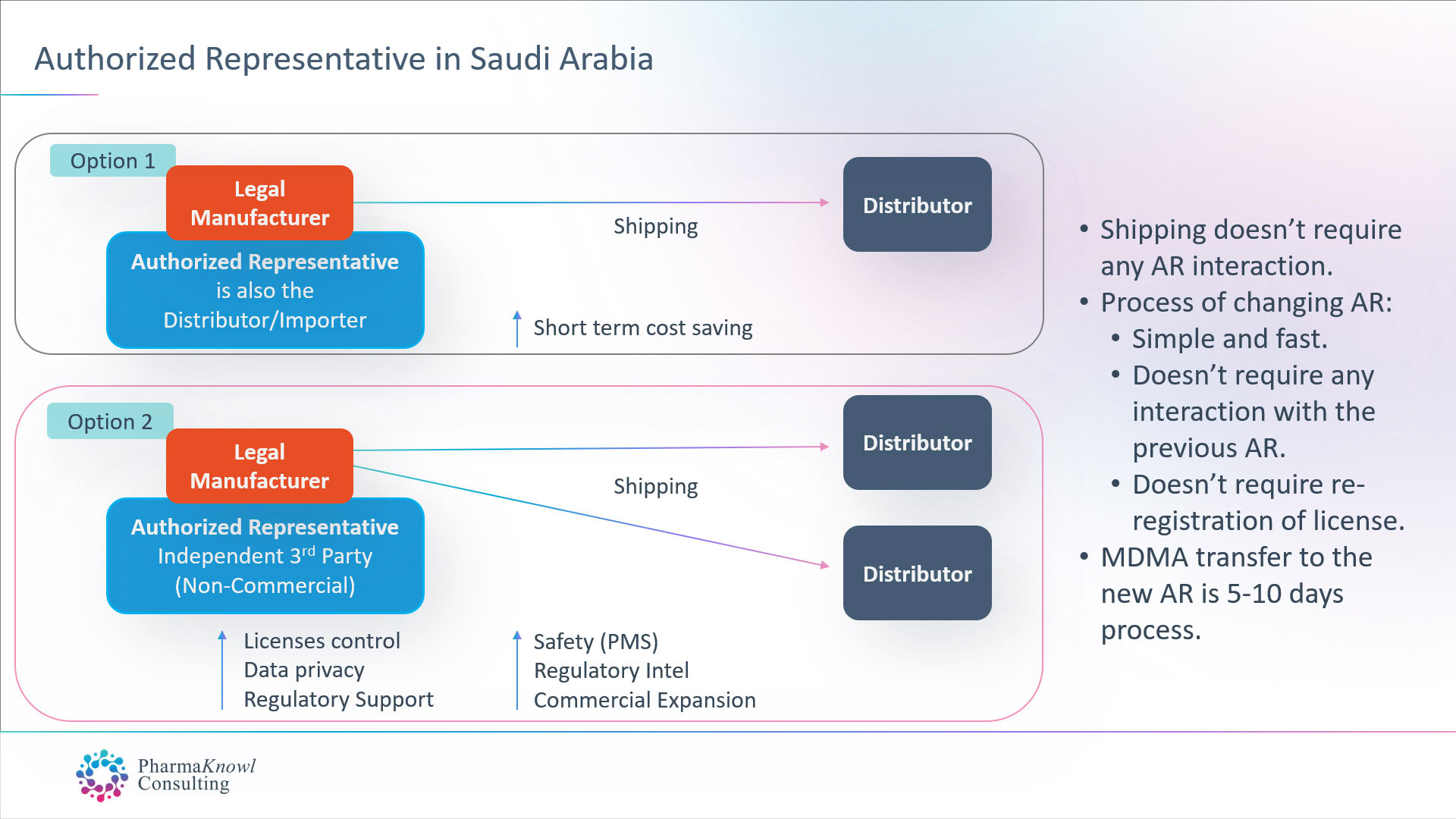
AR independiente vs. distribuidor como AR
Los fabricantes internacionales de dispositivos médicos tienen dos opciones cuando quieren designar un AR en Arabia Saudita:
- Designar a su distribuidor comercial como su AR.
- Designar un AR independiente (no comercial).
La mayoría de los fabricantes legales prefieren designar un AR independiente, ya que es la mejor opción en Arabia Saudita, similar a la práctica común en la UE.
Ventajas de AR independiente
Pagar una tarifa fija anual por un AR independiente sin ninguna comisión sobre los envíos proporciona a los fabricantes un conjunto de ventajas, tales como:
- Soporte regulatorio y post comercialización avanzado.
- Capacidad de registrar múltiples marcas para el mismo producto.
- Capacidad de enviar mercancías a múltiples distribuidores/importadores.
- Operaciones comerciales estables.
- Control sobre las licencias de productos
- Confidencialidad de los datos.
- Asesoramiento imparcial y conocimiento del mercado.
- Información regulatoria a tiempo.
- Altas habilidades de comunicación.
Responsabilidades
El AR debe proporcionar al fabricante legal lo siguiente:
- Representación legal autorizada en SFDA
- Apoyo regulatorio
- Presentar la Identificación Única del Dispositivo ( SFDA UDI )
- Aclaración de las regulaciones SFDA
- Información y perspectivas del mercado
- Actualizaciones de MDMA
- Vigilancia postcomercialización
- Notificación de eventos e incidencias adversos
- Presentación de acciones correctivas
- Realizar un seguimiento clínico posterior a la comercialización (PMCF) en Arabia Saudita
- Facilitar el mantenimiento del dispositivo
- Soporte para problemas de despacho de envíos
Cualidades estándar de AR
- Excelente cobertura de funciones esenciales.
Cumplimiento normativo, monitorización de seguridad, habilidades de comunicación, etc. - Inteligencia regulatoria:
Compartir rápidamente actualizaciones regulatorias con la capacidad de identificar áreas de impacto y niveles de riesgo. - Buen acceso a SFDA
Para apoyo y resolución de problemas. - Capacidades de planificación de la cadena de suministro
Por ejemplo, para los cronogramas de llegada frente a las fechas de aprobación y los permisos de importación. - Trabajos en sistemas electrónicos del fabricante
Actualizar hitos regulatorios como fechas de registro, vencimientos, renovaciones, etc. - Apoyar las inspecciones SFDA
- Facilita los trámites de embarque en el puerto.
- Resolver otros problemas dentro del mercado.

Clases de bajo riesgo
Anteriormente, SFDA exigía la RA solo para las clases de alto riesgo. Sin embargo, desde el 27 de septiembre de 2022, la RA también es obligatoria para los dispositivos de bajo riesgo. Esto coincidió con la cancelación del procedimiento de registro de bajo riesgo (MDNR).
Requisitos de licencia
A continuación, enumeramos los requisitos de SFDA para que una empresa local actúe como representante autorizado:
- Una empresa saudí con un registro comercial (CR) de actividad de dispositivos médicos.
- Disponibilidad de un Sistema de Gestión de Calidad (SGC)
- Un certificado ISO 13485 válido.
- Pasar la inspección SFDA
- Una licencia válida de establecimiento de dispositivos médicos (MDEL) SFDA
- Personal dedicado a funciones de seguridad y reglamentación.
- Acuerdo de representante autorizado firmado con el fabricante legal.
Acuerdo AR
La SFDA exige una plantilla de acuerdo AR específica que debe firmarse tal como está entre los fabricantes legales y su representante autorizado en Arabia Saudita.
A continuación se presentan algunas notas esenciales relacionadas:
- Los fabricantes pueden designar varios AR (con condiciones).
- El Acuerdo AR debe estar apostillado o legalizado.
- La validez mínima del AR es de un año.
- La validez del AR coincide con la duración del acuerdo o es menor.
Cambiar su representante autorizado
Cambiar el representante autorizado en Arabia Saudita no requiere la aprobación del representante autorizado anterior. El proceso dura una semana, tras lo cual se transfieren las licencias de dispositivos médicos (MDMA). Por lo tanto, no es necesario volver a registrar los productos tras transferir el representante autorizado.
Honorarios
La tarifa de la licencia SFDA para un certificado de representante autorizado es de 2600 SAR al año (693,33 USD). Para más información sobre las tarifas SFDA , consulte nuestro artículo: Tarifas de SFDA .
Proveedor representante autorizado
PharmaKnowl es un representante autorizado con licencia SFDA , en el que confían prestigiosas empresas de dispositivos médicos y tecnología médica de todo el mundo. Si necesita un representante autorizado para su primera entrada al mercado o para transferirse de un representante autorizado actual en Arabia Saudita, contáctenos para recibir una propuesta. También puede programar una reunión con nosotros para responder a sus preguntas.
Leer más
Registro SFDA



