
عن الكاتب
محمد جبران
مستشار شؤون تنظيمية لقطاع الدواء والتقنية الحيوية (بكالوريوس صيدلة، ماجستير في المعلوماتية الطبية الحيوية). أكثر من 20 عامًا من الخبرة، عمل في الهيئة العامة للغذاء والدواء، وشركات أدوية عالمية.
يجب تسجيل الأدوية في الهيئة العامة للغذاء والدواء (SFDA) قبل تسويقها في المملكة العربية السعودية. حيث ان الهيئة هي الجهة المنظمة للدواء لضمان المأمونية والفعالية والجودة. وتعد المملكة الأكثر تقدماً وصرامة في التنظيم الدوائي في الشرق الأوسط.
وتتطلب عملية تسجيل الأدوية إعداد وتحضير دقيق لملف التسجيل حيث تعتبر متطلبات الهيئة غاية في التقدم الفني والعلمي خاصةً وانها تعتمد متطلبات منظمة الـ ICH العالمية منذ عام 2009. علماً ان الهيئة تدرجت في المتطلبات ابتداءاً بالصيغة الورقية، مروراً بـ CTD ثم NeeS وصولاً إلى ملف eCTD.
في هذا المقال سنتطرق للمتطلبات العامة للتسجيل مع بعض التفصيل العلمي والفني للمتطلبات، والإشارة للأدلة التنظيمية المتعلقة.
جدول المحتويات
التخطيط للتقديم
من أفضل الممارسات التي ننصح بها للحصول على موافقة الهيئة العامة للغذاء والدواء هي البدء بتطوير استراتيجية تنظيمية (ولو مبسطة) وذلك قبل خوض غمار تجهيز الملف والإقدام على جمع متطلبات ملفات التسجيل. خاصةً للشركات والمستثمرين الجدد في السوق السعودي. حيث أن الإقدام على جمع الملفات وتقديمها للهيئة بدون مناقشة المشروع مع الخبراء التنظيميين هو عبارة عن تأجيل مواجهة العقبات الإعتيادية إلى المستقبل، حيث تتحول من عقبات يسهل تجاوزها إلى عقبات مكلفة مادياً وزمنياً.
يوفر التخطيط التنظيمي الإستراتيجي رؤية واضحة للتأثير التنظيمي القادم على الاستثمار مثل التكلفة، المتطلبات، العقبات المتوقعة، الدراسات الفنية الضخمة، المدة، الأطراف المرتبطة، السعر المتوقع، المنافسون، الخ. فهي بالتالي ضرورة قصوى لدعم تكوين قرار تجاري سليم من قبل المستثمرين والتنفيذيين في الشركات، وللعمل في مشروع تسجيل ميسر وخالي من العثرات.
ونظرًا لأن متطلبات ملف التسجيل هي أحد أركان الاستراتيجية التنظيمية، فإن العمل على تطوير خطة استراتيجية لايؤدي للتأخير. بل ان تطويرها قبل التقديم على الهيئة يساهم في النهاية في تعجيل عملية التسجيل ويجعلها أكثر فعالية وأقل تكلفة. إقرأ: تطوير إستراتيجية تنظيمية للسوق السعودي.
متطلبات تسجيل الأدوية
السؤال الأكثر شيوعًا الذي نتلقاه كمتخصصين في الشئون التنظيمية هو (ما هي متطلبات التسجيل؟) والذي لا يمكن الرد عليه بقائمة مبسطة بأسماء الملفات. وذلك لأن هناك إختلاف في المتطلبات حسب نوع النموذج، وتخصص الدواء العلاجي، وطريقة تصنيعة، إلخ. إضافةً انه يوجد متطلبات أمتثال خاصة بكل ملف من ملفات المنتج، والمصنع، والشركة المسوقة، والوكيل الموزع.
بالتالي، ما نقدمه في هذا المقال هو فقط خارطة طريق للمسثمرين والمتخصصين المستجدين في السوق السعودي لتوفير مايساعدهم على تقييم عمق العملية وطولها.
في هذا الاتجاه، قمنا بتجزئة المتطلبات إلى الأقسام التالية لتبسيطها:
قواعد تسجيل الأدوية
وفقًا لنوع الدواء، أدرجنا أدناه الأدلة الإرشادية والقواعد الملزمة المحتوية على متطلبات تسجيل الأدوية بالهيئة العامة للغذاء والدواء. لاحظ أنه يوصى بالتقديم على طلب تصنيف منتج في الهيئة العامة للغذاء والدواء وذلك لتحديد نوعه بدقة خاصة اذا كان مكمل غذائي أو صحي أو عشبي او من المنتجات الغير واضحة التصنيف.
وقبل كل هذا، لابد الحصول على تصريح لمزاولة النشاط التجاري وذلك بتقديم طلب ترخيص مستودع.
أدلة تسجيل الأدوية البشرية
نشرت الهيئة العديد منها، يجب تطبيقها على ملف المنتج والتأكد من الإمتثال الكامل، وهي كالتالي:
- متطلبات بيانات ملف تسجيل الأدوية البشرية
- دراسات الثباتية
- دليل الملف الرئيسي للأدوية للمادة الفعالية (DMF)
- معلومات الملصق والعبوة والنشرة الداخلية SPC وPIL
- دليل تسمية الأدوية
- متطلبات ضمانات عدم العبث – إرشادات التغليف
- دليل التصميم الجرافيكي لتغليف الأدوية
- دليل التكافؤ الحيوي
- دليل البدائل الحيوية
- دليل ومتطلبات فحص الأدوية البحثية (IND)
- دليل المعيار المرجعي (Reference Standards)
- دليل إستثناء دراسة التكافؤ الحيوي
- إرشادات إنتاج اللقاحات وضبط جودتها
أدلة تسجيل الأدوية العشبية
- متطلبات بيانات التقديم للمنتجات العشبية والصحية
- إرشادات تقديم معلومات PIL للمنتجات العشبية والصحية
- القواعد العامة للمنتجات التي تحتوي على فيتامينات ومعادن
أدلة تسجيل الأدوية البيطرية
- دليل النشرة الداخلية للممارسين SPC وملصقات المنتجات البيطرية
- مواصفات SFDA VNeeS للمنتج الطبي البيطري
- متطلبات بيانات تسجيل المنتجات الطبية البيطرية
متطلبات ملف الدواء
ملفات الملفات
- دواء جديد
وهذه هي الأدوية المبتكرة المكافئة للأدوية الجديدة، بما في ذلك الأدوية الحيوية المماثلة.- جميع الوحدات الخمس مطلوبة.
- دواء عام
- م1: جميع الأقسام
- م2: 2.1، 2.2، 2.3، 2.5.2
- م3: جميع الأقسام.
- م4: غير متوفر
- M5: 5.1، 5.2، 5.3.1.2، 5.3.1.3، 5.3.1.4، 5.3.7، و5.4 فقط
- المنتجات الصحية والعشبية
- م1: جميع الأقسام.
- م3: جميع الأقسام.
- الأدوية البيطرية:
- الجزء الأول
- الجزء الثاني
- الجزء الثالث
- الجزء الرابع
تنسيق الملف
- الدواء البشري: eCTD.
- المنتجات العشبية والصحية: CTD أو eCTD
- الأدوية البيطرية: vNEES أو CTD.
متطلبات الوحدة الأولى
- 1.0 خطاب التقديم
- 1.1 جدول المحتويات الشامل
- 1.2 نموذج الطلب
- 1.3 معلومات المنتج
- 1.3.1 ملخص خصائص المنتج (SPC)
- 1.3.2 وضع العلامات
- 1.3.3 نشرة معلومات المريض (PIL)
- 1.3.3.1 النشرة العربية
- 1.3.3.2 النشرة الإنجليزية
- 1.3.4 الأعمال الفنية (النماذج)
- 1.3.5 العينات
- 1.4 معلومات عن الخبراء
- 1.4.1 الجودة
- 1.4.2 غير سريري
- 1.4.3 سريري
- 1.5 تقييم المخاطر البيئية
- 1.5.1 الكائنات غير المعدلة وراثيًا
- 1.5.2 الكائنات المعدلة وراثيا
- 1.6 اليقظة الدوائية
- 1.6.1 نظام اليقظة الدوائية
- 1.6.2 خطة إدارة المخاطر
- 1.7 الشهادات والوثائق
- 1.7.1 شهادة GMP
- 1.7.2 CPP أو المبيعات المجانية
- 1.7.3 شهادة التحليل – مادة مخدرة / منتج نهائي
- 1.7.4 شهادة التحليل – المواد المساعدة
- 1.7.5 إعلان محتوى الكحول
- 1.7.6 إعلان محتوى لحم الخنزير
- 1.7.7 شهادة الملاءمة لـ TSE
- 1.7.8 المخففات وعوامل التلوين في تركيبة المنتج
- 1.7.9 معلومات براءة الاختراع
- 1.7.10 خطاب الوصول أو الإقرار إلى DMF
- 1.8 التسعير
- 1.8.1 قائمة الأسعار
- 1.8.2 وثائق أخرى ذات صلة
- 1.9 ردود على الأسئلة
نموذج تسجيل الدواء
يتوجب على المتقدمين تعبئة طلب تسجيل الأدوية وتقديمه عبر نظام تسجيل الأدوية السعودي (eSDR)، وهو بوابة إلكترونية متاحة للشركات السعودية المحلية، حيث تمكن المتقدمين من القيام بما يلي:
- تعبئة النموذج.
- دفع رسوم الطلب.
- إرسال الملف.
- تلقي استفسارات الهيئة العامة للغذاء والدواء (RFI).
- تلقي قرارات الهيئة العامة للغذاء والدواء.
- طباعة شهادة التسجيل.
- تقديم التغييرات والتجديدات (إدارة دورة الحياة).
أنواع النماذج
تأتي نماذج تسجيل الأدوية في eSDR في ثلاثة أنواع رئيسية مع المزيد من الأنواع الفرعية، على النحو التالي:
- دواء بشري
- دواء جديد
- بيولوجي
- دواء صيدلاني مشع
- دواء جنيس
- المنتجات الصحية و العشبية
- المنتجات البيطرية
- دواء جديد
- دواء بيولوجي
- دواء عام (متعدد المصادر)
- منتج بيطري عشبي
- منتج بيطري صحي
رسوم تقديم النموذج
تم طرح تحديث على رسوم تسجيل الأدوية بتضمين رسوم على نماذج نظام سدر، وذلك ابتداءاً من شهر مارس 2021م. للتفصيل اقرأ مقال: رسوم الهيئة.
تقديم الطلب
في الصورة التالية، رسم تخطيطي لعملية تقديم الطلب التي تدخل في مرحلتين من عمليات التحقق التي سنناقشها بعد ذلك.
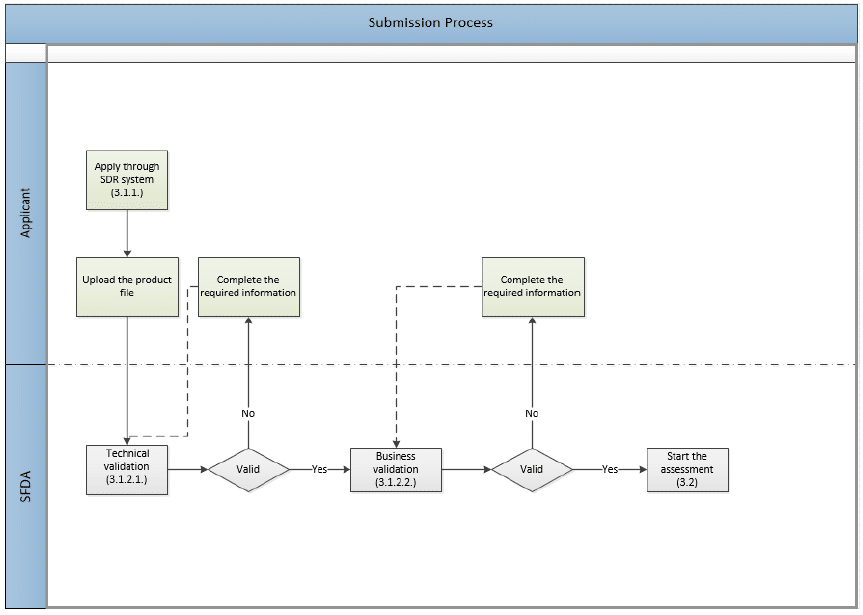
التحقق ومراجعة الملف
التحقق الفني
عند استلام الملف، تُجري الهيئة العامة للغذاء والدواء تصديقًا إلكترونيًا على eCTD المُجمَّع وفقًا لمعايير التحقق من صحة eCTD الخاصة بالهيئة. تجدر الإشارة إلى أنه حتى ملفات eCTD الصالحة يمكن رفضها بسبب أنواع أخرى من الأخطاء الفنية.
تحقق الأعمال
هي عملية يدوية أولية للتحقق من صحة المعلومات والمتطلبات والتي يتم إجراؤها على الملف بعد اجتياز التحقق الفني. وهي خطوة قبل الشروع في التقييم العلمي الفعلي. ويهدف إلى تقليل عدد أوجه القصور الواضحة في الملفات التي تم اكتشافها أثناء عملية التقييم.
في هذه العملية، ستتحقق الهيئة العامة للغذاء والدواء من صحة (وليس تقييم) تقديم الملف والامتثال مثل:
- نوع النموذج والرسوم
- التوافق مع MAH والشركة المصنعة والوضع القانوني.
- المكونات الصيدلانية النشطة (API)
- المنتج الصيدلاني النهائي (FPP)
- التجارب السريرية
- بيانات السلامة (SPC / PIL)
مدة التسجيل
تختلف مدة التقييم في قطاع الأدوية حسب نوع الطلب وما إذا كان المنتج قد حصل على موافقة التسجيل في الدول المرجعية . اقرأ: مدة التسجيل.
التسجيل المستعجل (أولوية)
هناك طريقتان للتسجيل السريع في الهيئة العامة للغذاء والدواء. الأول يعتمد على القيمة المضافة للدواء وهي أولوية التسجيل. والمسار الآخر مخصص لتلك الأدوية الموافق عليها بالفعل من قِبل FDA أو EMA، ويسمى التسجيل بالتحقق والتجسير.
تعيين الأدوية
تييح الهيئة طلب تعيين للدواء سواءاً تعيين الأدوية اليتيمة أو تعيين الأدوية الرائدة، وغيرها. وتتم هذه لعملية قبل تقديم الملف الرئيسي للتسجيل.
آلية مراجعة ملف الدواء
يعد فهم عملية مراجعة ملفات الأدوية ورحلتها في أقسام التقييم لدى الهيئة أمرًا ضروريًا للمهنيين التنظيميين لأنه يضع متطلبات التسجيل في السياق المفهوم وبالتالي يساعد في تحديد المرحلة التي تم الوصول لها فالتقييم.
تتم دراسة ملف الدواء بشكل متوازي تسمح لعدة أقسام بتقييم الملف في نفس الوقت. أقسام التقييم بالهيئة العامة للغذاء والدواء هي كالتالي:
قسم التقييم
الجودة
- المادة الصيدلانية الفعالة (API)
- المنتجات الصيدلانية النهائية (FPP)
الفعالية السريرية والسلامة
- التقييم السريري
- التكافؤ الحيوي (BE)
- معلومات السلامة المرجعية (RSI)
- ملخص خصائص المنتج (SPC)
- نشرة معلومات المريض (PIL)
التفتيش
قسم التفتيش مسؤول عن تقييم وتفتيش وتسجيل المصانع. حيث يجب على المتقدمين الحصول على ترخيص الممارسة الجيدة للتصنيع GMP لمصانع الأدوية والصحة والأعشاب والبيطرة. تتضمن عملية الترخيص فحصًا فعليًا للموقع من قبل مفتشي الهيئة ودفع رسوم التفتيش .
التحليل
- التحليل المعملي
- مراجعة وثائق التحليل ذات الصلة
- طلب عينات الأدوية والمعايير المرجعية
- تحليل الشحنات التجارية
التسعير
تقييم السعر هو آخر مراحل تقييم الدواء، ويقوم هذا القسم بإجراء دراسة اقتصادية دوائية عن الدواء وإعداد تقرير للجنة التسعير بالهيئة. والسعر الموصى به من قبل لجنة التسعير يتطلب الموافقة النهائية من لجنة التسجيل الرئيسية.
لجنة التسجيل
تتولى لجنة التسجيل الرئيسية في الهيئة مسؤولية مراجعة تقرير التقييم الشامل النهائي من جميع الإدارات. ثم تتخذ القرار النهائي بالموافقة على الطلب أو رفضه.
شهادة التسجيل
تحصل الأدوية الموافق عليها على شهادة تسجيل تخول الشركة من التسويق في المملكة العربية السعودية. وتاريخ صلاحية هذه الوثيقة هو 5 سنوات.
التغييرات
تتطلب التغييرات في أي معلومات إدارية أو فنية بداخل ملف الدواء تقديم الشركة للهيئة بطلب موافقة على تغيير. ويجب الموافقة على ذلك التغيير قبل استيراد الشركة لهذا الدواء المحدث. اقرأ: تقديم تغيير دواء.
تجديد الأدوية
يجب على الشركات تجديد شهادة التسجيل من خلال تقديم طلب تجديد قبل انتهاء صلاحية الترخيص بستة أشهر.
خاتمة
بعد معرفة أن طلب الدواء سوف يخضع لتقييم مكثف من قبل الخبراء بالهيئة العامة للغذاء والدواء، يجب على مقدم الطلب أن يتوقع موجات متعددة من الاستفسارات (RFIs) فيما يتعلق بالمواد الفعالة (API)، ودراسات الثباتية، والمواصفات حسب دستور الأدويةوالتجارب السريرية، والتكافؤ الحيوي، والتيقظ الدوائي.
خدمة تسجيل الأدوية
نتطلع في فارمانول لدعم مشاريع تسجيل الدواء في المملكة سواءاً للشركات المسوقة العالمية او الوكلاء المحللين. اتصل بنا لطلب إجتماع او استفسار.
اقرأ:
عن الكاتب
محمد جبران
مستشار شؤون تنظيمية لقطاع الدواء والتقنية الحيوية (بكالوريوس صيدلة، ماجستير في المعلوماتية الطبية الحيوية). أكثر من 20 عامًا من الخبرة، عمل في الهيئة العامة للغذاء والدواء، وشركات أدوية عالمية.
موارد وأدوات
أحداث وفعاليات
الخدمات









