
À propos de l'auteur
Mohammed Jobran
Consultant en réglementation (pharmacien BSc, informatique biomédicale MSc). Avec 19 ans d'expérience au sein de la SFDA, de sociétés multinationales et en tant que consultant professionnel.
L’Autorité saoudienne des produits alimentaires et pharmaceutiques ( SFDA ) exige des fabricants de dispositifs médicaux qu’ils désignent un représentant autorisé (RA) en Arabie saoudite avant de commercialiser leurs produits. Ce représentant sera le représentant local responsable des activités réglementaires telles que l’enregistrement des dispositifs médicaux et la surveillance post-commercialisation.
La désignation d’un mandataire nécessite la soumission d’un accord signé à la SFDA . La procédure est rapide et le fabricant peut également modifier le mandataire . Voici quelques remarques préliminaires :
- La nomination d’un AR est un processus qui prend entre 1 et 2 semaines.
- Le changement d’AR est possible à tout moment.
- Les fabricants peuvent désigner plusieurs AR (sous conditions).
- Une licence AR valide est nécessaire avant l’enregistrement et la commercialisation de l’appareil.
- Le dédouanement des expéditions nécessite une licence AR valide.
Cet article traitera du rôle d’AR et de la manière d’en nommer un pour votre entreprise.
Table des matières
Qu’est-ce qu’un représentant autorisé?
Le représentant autorisé est l’entreprise saoudienne locale qui représente légalement le fabricant international de dispositifs médicaux en Arabie saoudite. SFDA exige que les entreprises désignent un représentant autorisé avant d’enregistrer leur produit ; ce représentant autorisé n’est pas nécessairement le distributeur.
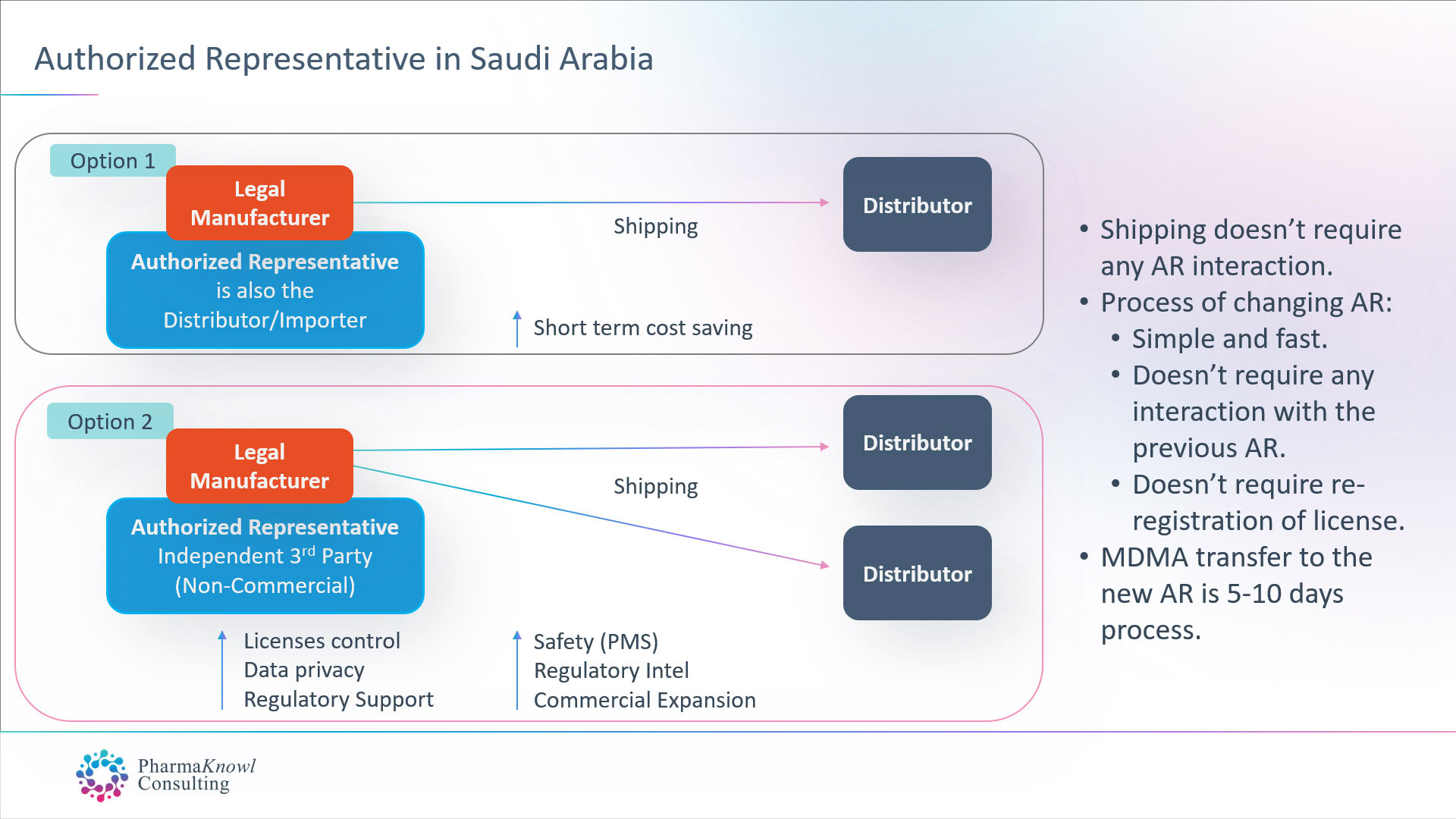
AR indépendant vs distributeur en tant qu’AR
Les fabricants internationaux de dispositifs médicaux ont deux options lorsqu’ils souhaitent désigner un AR en Arabie saoudite :
- Désignez leur distributeur commercial comme AR.
- Nommer un AR indépendant (non commercial).
La plupart des fabricants légaux préfèrent désigner un AR indépendant car c’est la meilleure option en Arabie saoudite, similaire à la pratique courante dans l’UE.
Avantages de la RA indépendante
Le paiement d’un forfait annuel pour un AR indépendant sans aucune commission sur les expéditions offre aux fabricants un ensemble d’avantages, tels que :
- Support réglementaire et post-commercialisation avancé.
- Possibilité d’enregistrer plusieurs noms de marque pour le même produit.
- Capacité d’expédier des marchandises à plusieurs distributeurs/importateurs.
- Opérations commerciales stables.
- Contrôle des licences de produits
- Confidentialité des données.
- Conseils impartiaux et informations sur le marché.
- Renseignements réglementaires ponctuels.
- Excellentes compétences en communication.
Responsabilités
L’AR doit fournir les éléments suivants au fabricant légal :
- Représentation légale et autorisée auprès de SFDA
- Soutien réglementaire
- Soumettre l’identification unique de l’appareil ( SFDA UDI )
- Clarification des réglementations SFDA
- Informations et perspectives sur le marché
- Mises à jour sur la MDMA
- Surveillance post-commercialisation
- Déclaration des événements indésirables et des incidences
- Soumission des mesures correctives
- Réaliser un suivi clinique post-commercialisation (PMCF) en Arabie saoudite
- Faciliter la maintenance des appareils
- Prise en charge des problèmes de dédouanement des expéditions
Qualités standard AR
- Excellente couverture des tâches essentielles
Conformité réglementaire, surveillance de la sécurité, compétences en communication, etc. - Renseignements réglementaires :
Partagez rapidement les mises à jour réglementaires avec la possibilité d’identifier les zones d’impact et les niveaux de risque. - Bon accès à SFDA
Pour le soutien et la résolution de problèmes. - Capacités de planification de la chaîne d’approvisionnement
Par exemple, pour les horaires d’arrivée par rapport aux dates d’approbation et aux permis d’importation - Travaux sur les systèmes électroniques des fabricants
Pour mettre à jour les étapes réglementaires telles que les dates d’enregistrement, les expirations, les renouvellements, etc. - Soutenir les inspections SFDA
- Facilite les démarches administratives d’expédition au port.
- Résoudre d’autres problèmes sur le marché.

Cours à faible risque
Auparavant, SFDA n’exigeait l’AR que pour les classes à haut risque. Cependant, depuis le 27 septembre 2022, l’AR est également obligatoire pour les appareils à faible risque. Cette décision a coïncidé avec l’ annulation de la procédure d’enregistrement des appareils à faible risque (MDNR).
Exigences en matière de licence
Nous listons ici les exigences SFDA pour qu’une entreprise locale agisse en tant que représentant autorisé :
- Une société saoudienne disposant d’un registre commercial (CR) d’activité de dispositifs médicaux.
- Disponibilité d’un système de gestion de la qualité (SMQ)
- Un certificat ISO 13485 valide.
- Réussir l’inspection SFDA
- Une licence d’établissement de dispositifs médicaux (MDEL) valide SFDA
- Personnel dédié aux fonctions de sécurité et de réglementation.
- Contrat de représentation autorisé signé avec le fabricant légal.
Accord AR
La SFDA impose un modèle d’accord AR spécifique qui doit être signé car il est conclu entre les fabricants légaux et leur représentant saoudien autorisé.
Voici quelques notes essentielles sur le sujet :
- Les fabricants peuvent désigner plusieurs AR (sous conditions).
- L’accord AR doit être apostillé ou légalisé.
- La validité minimale de l’AR est d’un an.
- La validité de l’AR correspond à la durée de l’accord ou est plus courte.
Changer votre représentant autorisé
Le changement de représentant autorisé en Arabie saoudite ne nécessite pas l’approbation de l’AR précédent. La procédure prend une semaine, suivie du transfert des licences des dispositifs médicaux (MDMA). Il n’est donc pas nécessaire de réenregistrer les produits après le transfert de l’AR.
Frais
Les frais de licence SFDA pour un certificat de représentant autorisé s’élèvent à 2 600 SAR par an (693,33 USD). Pour plus d’informations sur les frais SFDA , consultez notre article : Frais SFDA .
Fournisseur de représentants autorisés
PharmaKnowl est un représentant agréé agréé par SFDA , auquel font confiance de grandes entreprises de dispositifs médicaux et de technologies médicales du monde entier. Si vous avez besoin d’un AR pour votre première entrée sur le marché ou pour transférer un AR existant en Arabie saoudite, veuillez nous contacter pour recevoir une proposition. Vous pouvez également prendre rendez-vous avec nous pour répondre à vos questions.
En savoir plus
Enregistrement SFDA



