
عن الكاتب
محمد جبران
مستشار شؤون تنظيمية لقطاع الدواء والتقنية الحيوية (بكالوريوس صيدلة، ماجستير في المعلوماتية الطبية الحيوية). أكثر من 20 عامًا من الخبرة، عمل في الهيئة العامة للغذاء والدواء، وشركات أدوية عالمية.
تنظم الهيئة العامة للغذاء والدواء منتجات الأجهزة الطبية في السعودية لضمان سلامتها وفعاليتها وجودتها. لذا يتوجب على الشركات تسجيل الأجهزة الطبية قبل توريدها وبيعها في المملكة. وتسمى هذه الرخصة بإذن تسويق جهاز طبي (مدما MDMA).
علماً ان الهيئة طورت من متطلبات ملف تسجيل الجهاز الطبي لتواكب تقدم المعايير العالمية، مثل تغير النظام في أوربا من التوجيهات التنظيمية (MDD) إلى نظام الأجهزة طبية (MDR). وأدى ذلك إلى رفع معايير متطلبات التسجيل. فعلى سبيل المثال، أصبح تسجيل المستلزمات الطبية منخفضة المخاطر يتطلب الحصول على إذن تسويق (مدما) بعد ماكانت تسجل عن طريق النموذج المبسط MDNR. بالتالي اصبحت تتطلب توفر ملفاً فنياً متطوراً، وتعيين ممثل معتمد (AR).
وبعد إلإنتهاء من إصدار موافقة الهيئة، تصبح الشركات وممثليها مسؤولةً عن إمتثال الأجهزة بالمحافظة على صلاحية الرخصة وتجديدها وإجراء عمليات التحديث والتغيير عليها عند الحاجة. بالإضافة إلى تقديم بلاغات الجودة وتقارير السلامة وتحديث الهيئة بمعلومات الباركود (UDI).
في هذه المقالة، سنوضح متطلبات ملف التسجيل ونحدد الاختلافات في تصنيفاتها. ولمعرفة طريقة تسجيل الأنواع الأخرى من المنتجات، أقراً مقالة تسجيل المنتجات.
جدول المحتويات
مسارات التسجيل
كان هناك عدة مسارات يمكن من خلالها تسجيل الأجهزة في الهيئة، ولكن تم إلغائها وإعتماد نموذج مدما2 فقط لجميع أنواع الأجهزة الطبية. فيما يلي ملخص لجميع المسارات ونماذج تسجيل الأجهزة الطبية:
مسار السجل الوطني للأجهزة الطبية (MDNR)
كانت الشركات تستخدم تسجيل الأجهزة الطبية غير المعقمة وغير القابلة للقياس ومنخفضة المخاطر من خلال السجل الوطني للأجهزة الطبية (MDNR)، والمعروف أيضًا باسم “قائمة الأجهزة الطبية”، وهو معفى من MDMA وAR. ومع ذلك، في سبتمبر 2022، ألغت الهيئة العامة للغذاء والدواء إجراء MDNR . لذلك، يجب أن يكون لدى جميع الأجهزة ملف فني لـ MDMA مع (AR) معين في المملكة العربية السعودية.
مسار مدما 1 (GHTF)
في هذا المسار، والمعروف بـ MDMA 1، كانت الهيئة تعتمد على الموافقات من الدول الأعضاء في فريق العمل العالمي لتنسيق الأجهزة الطبية GHTF، مثل الاتحاد الأوروبي والولايات المتحدة وكندا وأستراليا واليابان. ولكن بحلول نهاية عام 2021، ألغت الهيئة هذا النموذج والذي كان مسارًا أبسط وأسرع لتسجيل الأجهزة عالية ومتوسطة المخاطر دون استفسارات فنية عميقة.
مسار مدما 2 (TFA)
منذ يناير 2022، أصبح يستوجب على جميع الأجهزة الطبية والتشخيصات المختبرية الحصول على ترخيص من الهيئة العامة للغذاء والدواء من خلال مسار تسجيل مدما 2 TFA (MDMA2). ونتج هذا المسار عن التحديثات التنظيمية المستمرة للهيئة المماثلة لـ EU MDR وIVDR والذي يتطلب تقديم ملف فني متكامل شامل على دراسات إكلينيكية وجودة وسلامة.
وبالتالي أصبحت متطلبات التسجيل أكثر صرامة، مع وجود العديد من الشروط التي يجب استيفاؤها والدراسات التي يجب تقديمها، مثل تقرير التقييم السريري (CER)، وتقرير اختبار التوافق الحيوي، والحاجة إلى إجراء دراسة متابعة سريرية بعد التسويق (PMCF) في المملكة العربية السعودية لبعض أنواع الأجهزة عالية المخاطر.
وعلى الرغم من أن متطلبات هذا المسار مماثلة لمتطلبات الاتحاد الأوروبي (علامة CE)، فإن هيئة الغذاء والدواء لا تشترط وجود شهادة السي إي CE.
متطلبات التسجيل
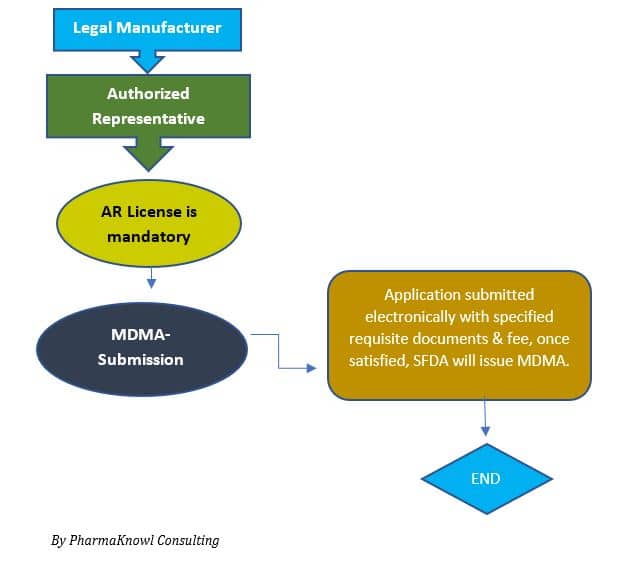
أول خطوة مطلوبة قبل البدء في التسجيل هي تعيين ممثل معتمد، وبعدها يمكن لمقدم الطلب تقديم طلب تسجيل المنتج. فيما يلي ملخص للمتطلبات، والتي تختلف وفقًا لنوع المنتج وفئته:
- جدول المحتويات
- وصف الجهاز
- الاستخدام/الغرض المقصود
- سجل الجهاز
- تصنيف الجهاز.
- ملصق الجهاز
- موديلات الأجهزة والملحقات والإصدارات
- تعليمات الاستخدام
- معلومات التصميم
- معلومات التصنيع
- المبادئ الأساسية (قائمة EP) للسلامة والأداء (قائمة التحقق الأساسية المطلوبة)
- تحليل الفوائد والمخاطر
- ملف إدارة المخاطر (الخطة والتقرير)
- الاختبارات ما قبل السريرية
- تقارير الاختبار
- تقارير اختبار التوافق الحيوي.
- خطة وتقرير التحقيق السريري
- تقرير التقييم السريري
- المتابعة السريرية بعد التسويق (PMCF)
- مراقبة ما بعد التسويق (PMS)، الخطة والتقرير
- تقرير التحديث الدوري للسلامة (PSUR) للأجهزة الطبية.
عملية التسجيل
الوقت اللازم: 90 يوم
يمكننا تلخيص عملية الموافقة على تسجيل الأجهزة الطبية (MDMA) في الخطوات القليلة التالية:
- تعيين ممثل معتمد
يتعين على الشركات المصنعة تعيين شركة طبية كممثل معتمد لتمثيل شركتها قانونياً وتنظيمياً امام الهيئة. اقرأ عن تعيين ممثل معتمد للأجهزة الطبية.
- تحليل الفجوات وإكتمال الملف
قبل تقديم الملف، يجب إجراء تحليل شامل للفجوات بين ملف التسجيل الموجود لدى المصنع ومتطلبات الهيئة. وهي خطوة ضرورية لأن عدم وجود بعض الدراسات مثل دراسة الاستقرار والدراسة الإكلينيكية (CER)ودراسة التوافق البيولوجي قد يؤدي إلى رفض الملف وخسارة الوقت والرسوم.
- تقديم نموذج المدما
يقوم المتقدم بإرسال الملف الفني إلى الهيئة العامة للغذاء والدواء.
- تحقق الهيئة
تقوم الهيئة بعملية تحقق مبدأية من صحة طريقة تقديم الملف دون الإطلاع على محتواه أو تقييمه.
- دفع الرسوم
سيتلقى مقدم الطلب فاتورة من الهيئة العامة للغذاء والدواء يتوجب سدادها قبل بدء التقييم.
- تقييم الملف
تقوم الهيئة بمراجعة محتوى الملف فنياً وعلمياً للتأكد من إكتمال الدراسات وتوافقة مع متطلبات الجودة، والفعالية، والسلامة. خلال هذه العملية، يتم إرسال استفسارات فنية على عدة دفعات يتعين على مقدم الملف من الرد عليها خلال فترة محددة.
- الموافقة وإصدار الشهادة
بعد تجاوز مرحلة تقييم الملف، تصدر الهيئة شهادة إذن تسويق المعروفة بالمدما والتي تمكن الشركة من بدء تسويق المنتج في السعودية.
تصنيف الأجهزة
من مسؤولية مقدم الطلب تصنيف الجهاز الطبي وفقًا لقواعد الهيئة العامة للغذاء والدواء. وهي جزء من الملفات المطلوبة في السعودية فقط بداخل الملف الفني. فبشكل عام، يمكن معرفة التصنيف المطلوب بمعرفة التصنيف المتبع في لائحة الاتحاد الأوروبي المرجعية (شهادة CE).
ومع ذلك، لن تأخذ الهيئة العامة للغذاء والدواء في الاعتبار لوائح الدول الأخرى؛ مثلاً، الجهاز الطبي منخفض المخاطر في دولة ما قد يصنف كعالي المخاطر في السعودية، والعكس صحيح.
تصنيف الأجهزة الطبية في الهيئة هو إما الفئة (أ) أو (ب) أو (ج) أو (د) وفقًا لفئة المخاطر كما هو موضح في الجدول أدناه:
| تصنيف الهيئة العامة للغذاء والدواء | فئة المخاطر | قاعدة تصنيف MDR |
| الفئة أ | منخفض | I |
| الفئة أ – معقمة | منخفض-متوسط | Is |
| الفئة أ – بوظيفة قياس | منخفض-متوسط | Im |
| الفئة أ – الأدوات الجراحية القابلة لإعادة الاستخدام | منخفض-متوسط | Ir |
| الفئة ب | منخفض-متوسط | IIa |
| الفئة ج | متوسط-عالي | IIb |
| الفئة د | عالي | III |
ويتم إستخدام القواعد التالية لتصنيف المخاطر للأجهزة الطبية التالية:
- الاستخدام المقصود Intended use.
- مستوى المخاطر (احتمالية الضرر وشدته للمرضى والمستخدمين وغيرهم).
- تلامس الجهاز على جسم الإنسان أو بداخله (إجتياحي)
- مدة الاستخدام (مؤقت، قصير الأمد، طويل الأمد).
علماً أنه قد يتم تصنيف الأجهزة المتطابقة بشكل مختلف، وذلك وفقًا للجزء المستهدف من الجسم. لذلك، فإن الاستخدام المقصود مهم جداً في تحديد التصنيف الصحيح. والمرجع للإستخدام المقصود هو:
- تعليمات الاستخدام (IFU)
- الملصق
- المواد الترويجية
- الملف الفني
وفيما يتعلق بأجهزة التشخيص المختبري IVDs، تعتمد الهيئة تصنيفاً مماثلاً للائحة الأجهزة الطبية الأوروبية IVDR:
| تصنيف SFDA IVD | فئة المخاطر | قاعدة التصنيف |
| الفئة أ | منخفض المخاطر الفردية ومخاطر الصحة العامة | A |
| الفئة ب | مخاطر فردية معتدلة و/أو مخاطر صحية عامة منخفضة | B |
| الفئة ج | مخاطر فردية عالية و/أو مخاطر صحية عامة معتدلة | C |
| الفئة د | مرتفع المخاطر الفردية ومخاطر الصحة العامة | D |
يكون مقدم الطلب مسؤولاً عن تحديد فئة جهاز التشخيص المختبري من خلال:
- تطبيق قواعد التصنيف للأجهزة الطبية التشخيصية المختبرية
- مع الأخذ بعين الاعتبار:
- الاستخدام المقصود
- مستوى المخاطر
دمج الأجهزة في نموذج المدما
يُسمح بتجميع ودمج أكثر من جهاز في نفس الطلب إلى عدد أقصى 50 بند في نفس النموذج وبنفس رسوم جهاز واحد، ولكن يجب أن تستوفي جميع هذه الأجهزة عدة شروط، مثل أن تكون لها نفس فئة المخاطر والاستخدام المقصود.
| نوع التجميع | الشروط | أمثلة |
| Single Product | A device sold in multiple sizes or models with the same intended use | Syringes with different volumes |
| Family | Devices with the same risk class, manufacturer, design, and intended use | Catheters of varying lengths |
| System | Devices intended to operate together for a common purpose | ECG machine + electrodes + leads |
| Set | Devices packaged together and intended for a common medical purpose | Surgical kits or dental kits |
| Software Suite | Related software modules that work as part of the same platform | Hospital management or imaging analysis software |
| IVD’s | Can be bundled in case of the same risk class, manufacturer, design, and intended use | Blood collection tubes, Culture media |
مدة التسجيل
تختلف الجداول الزمنية للتقييم وفقًا للعديد من العوامل، مثل فئة المخاطر، وتعقيد المنتج، وعدد المنتجات المجمعة، واكتمال الملف. فقد تؤدي النواقص الغير مكتشفة قبل التقديم إلى تأخير الموافقة. لمعرفة الوقت المستغرق لتقييم المنتج من قبل الهيئة، أقرأ المقالة المحدثة: مدة تسجيل المنتجات في هيئة الغذاء والدواء.
الرسوم
تختلف رسوم المدما وفقًا لفئة مخاطر الجهاز الطبي المقدم. راجع مقالتنا المحدثة رسوم هيئة الغذاء والدواء.
التجديد
تبلغ مدة صلاحية شهادة المدما ثلاث سنوات. ويمكن للمصنعين تقديم طلب التجديد قبل ثلاثة أشهر (90 يومًا) من انتهاء صلاحية الترخيص. وإذا كان التسجيل المنتهي مقدم عن طريق مسار المدما 1 (GHTF)، فستكون عملية التجديد طويلة وبمتطلبات مكثفة. أما عملية تجديد مدما 2 تكون أسرع.
التحديث والتغيير
لإجراء تحديث او تغيي في الجهاز الطبي المسجل، يجب على الشركات المصنعة تقديم طلب تحديث مدما. وتصنف الهيئة أنواع التغييرات إلى كبيرة (رئيسية) أو غير مهمة (طفيفة). ويختلف كلاهما في الرسوم والوقت المستغرق.
يمكن تقديم الطلب في أي وقت أثناء صلاحية الشهادة، علماً ان التغييرات الطفيفة لا تتطلب موافقة مسبقة ولكن يجب إخطار الهيئة قبل تسويق المنتج المتأثر.
شهادة المدما
تصدر هيئة الغذاء والدواء شهادة مدما MDMA باللغتين العربية والإنجليزية تحتوي على ما يلي:
- معلومات الشركة المصنعة
- معلومات عن الأجهزة الطبية ومجموعة الأجهزة الطبية.
- أرقام القائمة الوطنية للأجهزة الطبية.
- فترة الصلاحية
- رقم الشهادة
أنواع الأجهزة الطبية
أدناه، قائمة بالمنتجات التي تصنف في الهيئة كجهاز طبي، نسردها هنا على سبيل المثال لا الحصر:
- أجهزة التشخيص:
- أجهزة التصوير: أجهزة الأشعة السينية، وأجهزة التصوير المقطعي المحوسب.
- أجهزة المراقبة: أجهزة تخطيط القلب وأجهزة مراقبة ضغط الدم.
- أجهزة التشخيص المختبري: اختبارات الحمل، وأجهزة قياس نسبة السكر في الدم.
- الأجهزة العلاجية:
- أجهزة التنفس: أجهزة التنفس الصناعي، وأجهزة الاستنشاق.
- أجهزة التسريب: مضخات الأنسولين، ومعدات العلاج الوريدي.
- أجهزة إعادة التأهيل: الكراسي المتحركة والأطراف الاصطناعية.
- الأجهزة القابلة للزرع:
- أجهزة القلب والأوعية الدموية: أجهزة تنظيم ضربات القلب، والدعامات.
- زراعة العظام: استبدال مفصل الورك، قضبان العمود الفقري، استبدال المفاصل.
- الأدوات الجراحية:
- أدوات القطع: المشارط، والمقصات الجراحية، والملقط.
- الدباسات والخيوط الجراحية: الدباسات الجراحية والخيوط القابلة للامتصاص.
- الأجهزة السنية:
- المواد الترميمية: التيجان والحشوات السنية.
- الأجهزة التقويمية: الأقواس، والمثبتات.
- أخرى: مثاقب الأسنان
- الأجهزة الطبية للعيون:
- العدسات التصحيحية: العدسات اللاصقة والنظارات الطبية.
- المعدات الجراحية: أجهزة الليزك، والعدسات داخل العين.
- البرامج الطبية:
- برامج التشخيص: الذكاء الاصطناعي لتحليل الصور.
- برنامج تخطيط العلاج: أدوات تخطيط العلاج الإشعاعي.
- معدات المختبر:
- أجهزة التحليل: أجهزة تحليل غازات الدم وأجهزة تحليل أمراض الدم.
- معدات التعقيم: الأوتوكلافات، أجهزة التعقيم بالأشعة فوق البنفسجية.
- أجهزة الرعاية الصحية المنزلية:
- أجهزة المراقبة: أجهزة مراقبة نسبة السكر في الدم ومقاييس الحرارة الرقمية.
- مساعدات التنقل: المشايات، والدراجات البخارية الكهربائية.
- الأجهزة العلاجية (على سبيل المثال، أجهزة غسيل الكلى)
إذن إستيراد الأجهزة الطبية (MDIL)
يتطلب استيراد الأجهزة الطبية وجود شهادة مدما سارية، ولكن بعض الأجهزة قد تعفى من التسجيل وبالتالي تتطلب إذن استيراد، ويسمى هذا الإذن برخضة إستيراد جهاز طبي (Medical Device Import License – MDIL) والذي ينطبق على بعض أنوع الأجهزة مثل:
- أجهزة طبية لأغراض العرض أو التدريب.
- المواد الكيميائية
تعفى إذا كانت كمنتج نهائي غير أولي سواء تستخدم على حدة أو مع أجهزة أخرى
أمثلة: الغازات المستخدمة لمعايرة الأجهزة الطبية، المواد الكيميائية المستخدمة في التعقيم أو تشغيل الأجهزة الطبية، المستخدمة في تصنيع الأطراف الصناعية، والمستخدة في المحافظة على الأنسجة أو الخلايا).
ويستثنى من هذه المواد الكيميائية:- المشعة منها
- المستخدة في التشخيص الطبي
- المستخدة في التشخيص الغير طبي
- السلائف الكيميائية.
- أجهزة التقطير المستخدمة من قبل مقدمي الرعاية الصحية أو المرافق التعليمية.
- منتجات الاستخدام البحثي والتعليمي.
- الأجهزة والمستلزمات الطبية شبه المصنعة (الكيميائية الخام وغير الخام) والتي تستخدم في التصنيع المحلي للأجهزة (يشمل التصنيع التجديد والتجميع والتغليف وطباعة الملصق الطبي).
تسجيل شركات الأجهزة الطبية
أيضاً تقوم الهيئة بتنظيم وتسجيل شركات الأجهزة الطبية في السوق السعودي، وتفرض متطلبات أخرى على الشركات العالمية، وفيما يلي المتطلبات لكلا النوعين:
شركة سعودية محلية
تقوم الهيئة بإصدار تراخيص لشركات الأجهزة الطبية المحلية مثل المستوردين والموزعين والمستودعات والمصنعين. ويطلق على هذه التراخيص ترخيص منشأة الأجهزة الطبية (MDEL). ويجب قبل ذلك على جميع أنواع الشركات السابقة تطبيق نظام إدارة الجودة (QMS) والحصول على شهادة ISO 13485.
مصانع الأجهزة الأجنبية
يتعين على الشركات المصنعة القانونية الأجنبية تعيين ممثل معتمد في السعودية؛ وهذه هي الخطوة الأولى لتمكين التواصل مع الهيئة. وتتمثل المسؤولية الأساسية للممثل المعتمد في الامتثال للمنتج في أنشطة ما قبل التسويق وما بعده. والمحافظة على تواجد تسجيل ساري للأجهزة، ودعم فسح الشحنات، ومراقبة سلامة المنتج وجودته بعد التسويق، وتبليغ الهيئة عن أي حالات تؤثر على سلامة وجودة الجهاز الطبي.
خدمة التسجيل
سواء كانت شركتك جديدة أو نشطة في السوق السعودية، فإننا في فارمانول متخصصون في دعم التسجيل والإمتثال لقواعد الهيئة العامة للغذاء والدواء. فارمانول هي شركة استشارية مرخصة من الهيئة لتقديم خدمات تنظيمية وتمثيل معتمد في المملكة للشركات العالمية. اتصل بنا للمزيد من المعلومات.
عن الكاتب
محمد جبران
مستشار شؤون تنظيمية لقطاع الدواء والتقنية الحيوية (بكالوريوس صيدلة، ماجستير في المعلوماتية الطبية الحيوية). أكثر من 20 عامًا من الخبرة، عمل في الهيئة العامة للغذاء والدواء، وشركات أدوية عالمية.
موارد وأدوات
أحداث وفعاليات
الخدمات










