
著者について
モハメド・ジョブラン
規制コンサルタント(薬剤師学士、生物医学情報学修士)。SFDA、多国籍企業、および専門コンサルタントとして 19 年間勤務した経験があります。
サウジアラビア食品医薬品局( SFDA )は、医療機器メーカーに対し、製品の販売前にサウジアラビア国内に認定代理人(AR)を任命することを義務付けています。ARは、医療機器の登録や市販後調査といった規制活動を担当する現地代理人となります。
認定代理人を選任するには、 SFDAに署名済みの契約書を提出する必要があります。手続きは迅速で、製造業者は認定代理人の変更も可能です。以下に、いくつかの注意事項を記載します。
- AR の任命には 1 ~ 2 週間かかります。
- ARの変更はいつでも可能です。
- メーカーは複数の AR を任命することができます(条件付き)。
- デバイスの登録およびマーケティングの前に、有効な AR ライセンスが必要です。
- 出荷通関には有効な AR ライセンスが必要です。
この投稿では、AR の役割と、会社に AR を任命する方法について説明します。
権限のある代表者とは何ですか?
認定代理人とは、サウジアラビアにおいて国際的な医療機器メーカーを法的に代表するサウジアラビアの現地企業です。SFDA(サウジアラビア食品医薬品SFDA、企業に対し、製品の登録前に認定代理人を任命することを義務付けていますが、認定代理人は必ずしも販売代理店である必要はありません。
独立系 AR とディストリビューター AR
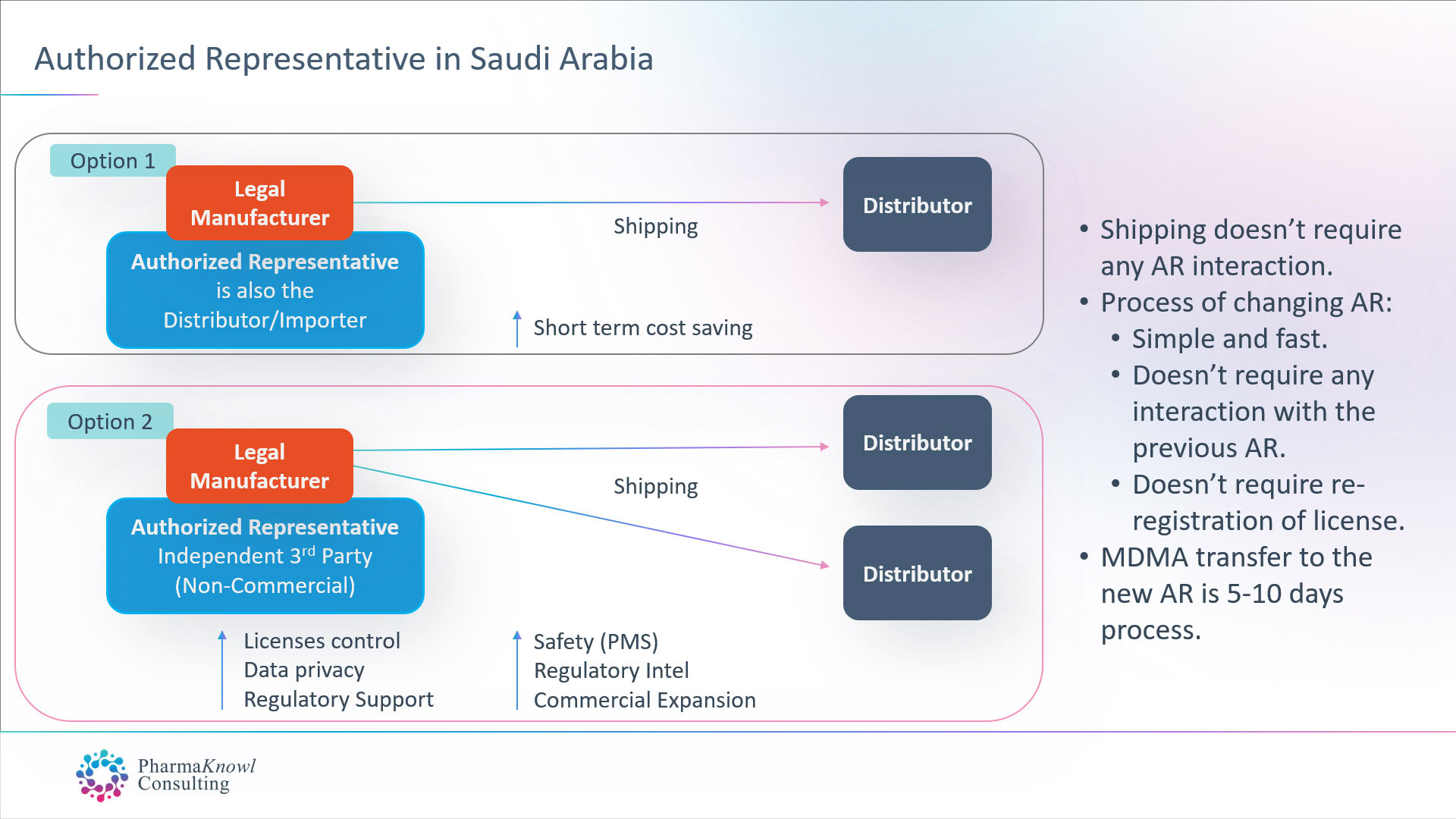
国際的な医療機器メーカーがサウジアラビアに AR を任命する場合、次の 2 つの選択肢があります。
- 自社の商用販売代理店を AR として任命します。
- 独立した AR(非営利)を任命します。
ほとんどの合法的な製造業者は、EU での一般的な慣行と同様に、サウジアラビアでは独立した AR を任命することが最善の選択肢であるため、独立した AR を任命することを好みます。
独立したARの利点
出荷手数料なしで独立した AR に年間固定料金を支払うと、メーカーには次のような一連のメリットがもたらされます。
- 高度な規制および市販後サポート。
- 同じ製品に複数のブランド名を登録できます。
- 複数の販売業者/輸入業者に商品を発送する機能。
- 安定した事業運営。
- 製品ライセンスの管理
- データの機密性。
- 公平なアドバイスと市場洞察。
- オンタイムの規制情報。
- 高いコミュニケーション能力。
責任
AR は、合法的な製造業者に次の情報を提供する必要があります。
- SFDAにおける法的、公認代理人
- 規制支援
- 固有デバイス識別子( SFDA UDI )を提出する
- SFDA規制の明確化
- 市場情報と洞察
- MDMAの最新情報
- 市販後調査
- 有害事象および発生率の報告
- 是正措置の提出
- サウジアラビアで市販後臨床フォローアップ(PMCF)を実施する
- デバイスのメンテナンスを容易にする
- 出荷通関問題のサポート
AR標準品質
- 必須の職務を完璧にカバー
規制遵守、安全監視、コミュニケーションスキルなど。 - 規制情報:
影響領域とリスク レベルを特定しながら、規制の最新情報を迅速に共有します。 - SFDAへのアクセス良好
サポートと問題解決のため。 - サプライチェーン計画機能
例: 到着スケジュールと承認日および輸入許可 - メーカーの電子システムに関する作業
登録日、有効期限、更新などの規制上のマイルストーンを更新します。 - SFDA検査をサポート
- 港での出荷書類手続きを容易にします。
- 市場内のその他の問題を解決します。

低リスククラス
これまで、 SFDA高リスククラスのみにARを義務付けていました。しかし、2022年9月27日以降、低リスクデバイスにもARが義務付けられました。これは、低リスク登録手続き(MDNR)の廃止と時期を同じくしています。
ライセンス要件
ここでは、現地企業が認定代理人として活動するためのSFDA要件を示します。
- 医療機器活動の商業記録 (CR) を持つサウジアラビアの企業。
- 品質管理システム(QMS)の可用性
- 有効なISO 13485 証明書。
- SFDA検査に合格
- 有効なSFDA医療機器施設ライセンス(MDEL)
- 安全および規制機能の専任スタッフ。
- 合法的な製造業者との正規代理店契約に署名しました。
AR契約
SFDA、合法的な製造業者とサウジアラビアの公認代理人の間で署名が必要な特定の AR 契約テンプレートを義務付けています。
関連する重要な注意事項をいくつか示します。
- メーカーは複数の AR を任命することができます(条件付き)。
- AR 契約はアポスティーユ認証または公証を受ける必要があります。
- AR の最小有効期間は 1 年です。
- AR の有効期間は契約期間と一致するか、それより短くなります。
代理人の変更
サウジアラビアにおける認定代理人の変更には、以前のAR(代理権者)の承認は必要ありません。手続きには1週間かかり、その後、医療機器ライセンス(MDMA)の移転が行われます。したがって、ARの移転後に製品の再登録を行う必要はありません。
料金
SFDA認可代理人証明書のライセンス料金は、年間SAR 2,600(USD 693.33)です。SFDASFDA料金に関する詳細は、 SFDA料金に関する記事をご覧ください。
認定代表プロバイダー
PharmaKnowlは、世界中の著名な医療機器・医療技術企業から信頼されているSFDA認可の正規代理店です。サウジアラビア市場への初めての参入、または既存のARからの移行をご希望の場合は、お気軽にお問い合わせください。ご提案をさせていただきます。また、ご質問にお答えするための面談も承っております。
続きを読む
SFDA登録



