
著者について
規制編集者
PharmaKnowl リヤド オフィスの規制業務チームによって発行されました。
SFDA、 SFDA製品登録プロセスにおいて企業が遵守しなければならない厳格なラベルおよび包装要件を定めています。承認後は、製品のコンプライアンスを維持し、出荷拒否や市場からの撤退を回避するために、ラベル情報を少しでも変更してはなりません。
この記事では、医薬品および医療機器の表示要件について説明します。
目次
医薬品ラベル
SFDA特定の表示要件は、医薬品のアートワークを構成するすべての構成要素(箱、ラベル、箔、添付文書(患者情報リーフレットPIL)、製品特性概要(SPC)など)に適用する必要があります。これらの構成要素はサウジアラビアにおける主要な医薬品登録要件の一つであるため、ここでは各構成要素に関する高レベルの要件を概説します。
外装・内装(二次包装)
医薬品名
製品の説明は、箱の6面のうち、向かい合わない3面以上に表示する必要があります。英語とアラビア語で記載してください。
有効成分の説明
有効成分の発現は、投与単位ごとに定性および定量的に提示する必要があります。英語とアラビア語で記載する必要があります。
適応症の表明
製品の効能はパッケージに強調表示する必要があります。例:治療、予防など
添加剤一覧
既知の効果または作用を有する添加物は、定性的に表現する必要があります。医薬品が非経口、局所、点眼薬、または吸入用である場合は、すべての添加物について記載する必要があります。
薬剤の形態と内容
内容量は、重量、容量、投与回数、または投与単位数(例:10 錠、100 mL など)で記載する必要があります。
投与方法および投与経路
適切な医薬品の使用法と使用上の注意を明確に記載する必要があります。例:「使用前によく振ってください。使用方法については、添付文書を参照してください。」
特別警告
ラベルには、「日光を避けてください。お子様の手の届かない場所に保管してください。外用のみに使用してください。」などの特別な警告を強調表示する必要があります。
保管条件
製品の保管条件を記載する必要があります (例: 25 ℃以下で保管、30 ℃以下で保管)。複数回投与製品の場合は、使用中の安定性を追加する必要があります (例: 最初の開封後の保存期間は 1 か月、2 か月、3 か月など)。これは、 SFDA安定性調査で述べられている内容を反映する必要があります。
製造業者およびMAH
製造業者および販売認可保有者の氏名と住所を記載する必要があります。
ブリスターまたはストリップ(一次包装)
医薬品名
製品名と強度は、各ブリスターポケットの上に表示する必要があります。ポケットが小さすぎる場合は、ストリップ全体に同じパターンで情報を繰り返し表示する必要があります。SFDASFDA全部品に英語とアラビア語のラベル表示を義務付けており、これらの言語での記載が必須です。
販売承認保有者の名称
ブランド名だけで十分です。
製造日と有効期限
日付は、たとえば 02/2010 または Feb 2010 のように表記する必要があります。
バッチ番号
バッチ(ロット)番号と有効期限は各ブリスターストリップの末尾に記載する必要があります。
製品特性の概要 SPC
SPCまたはSmPCは印刷されて医薬品に同梱されることはありません。ただし、 SFDAラベル表示要件は適用されます。承認されたSmPCのみが医療従事者に配布され、販促資料として使用できます。
基本情報
医薬品の名称、効力、剤形。
質的および量的構成
有効成分は単位量あたりの投与量で表記する必要があります。添加剤については、例えば「添加剤の全リストについては、『添加剤リスト』の項を参照してください」といった標準的な記述を含める必要があります。
薬剤形態
製品の剤形(例:フィルムコーティング錠、徐放錠など)を、剤形の説明とともに記載する必要があります。錠剤に割線が施されている場合は、割線が錠剤の割を容易にするのか、それとも錠剤を均等に分割するのかについても記載する必要があります。
臨床詳細
治療適応症
適応症では、治療または予防の対象となる疾患または状態と、成人、新生児、乳児、小児、および青年(月齢、年齢)におけるその適応症を定義する必要があります。
用量と投与方法
必要に応じて、各カテゴリーについて投与間隔ごとに推奨用量を明記する必要があります(対象集団の年齢、体重、体表面積を適切に設定してください)。高齢者、腎機能障害、肝機能障害、小児といった特別な集団に関する情報も提供する必要があります。また、製品の取り扱いおよび投与に関する予防措置についても提供する必要があります。
禁忌
これらは、有効成分またはいずれかの賦形剤に対する過敏症など、安全上の理由から医薬品を投与してはならないケースです。
使用上の注意
特定のリスクに関する情報、特定のリスク最小化対策、副作用、安全性情報、
インタラクション
臨床相互作用研究(in vivo)、薬力学的相互作用、薬物動態学的相互作用。
生殖能力、妊娠、授乳
妊娠中、授乳中の女性、および妊娠の可能性のある女性への使用に関する推奨事項は、臨床試験、非臨床試験、および薬理学的活性に基づいている必要があります。
運転や機械の操作能力への影響
望ましくない影響
安全性プロファイル、有害反応、および副作用を報告するための国の当局の住所の概要。
過剰摂取
偶発的、間違い、または自殺未遂によって摂取されたさまざまな投与量レベルの影響。
薬理学的特性
内容量は、重量、容量、投与回数、または医薬品投与単位数(例:10 錠、100 mL など)で記載する必要があります。
医薬品の詳細
- 添加剤一覧
- 非互換性
- 貯蔵寿命
- 保管上の注意
- 容器の性質と内容物。
廃棄および取り扱いに関する特別な注意事項
廃棄に関する特別な要件がある場合、「特別な要件なし」と記載できます。廃棄は地域の規制に従ってください。
販売承認保有者
販売承認番号
最初の認可日/認可の更新日
テキストの改訂日
患者情報リーフレット(PIL)
(造語)とは何か、そして何に使われるのか
発明名、効能、剤形、有効成分、治療適応症、およびこの医薬品を使用する利点。
製品を摂取または使用する前に
禁忌、適切な使用上の注意/特別な警告、他の医薬品/食品/飲料との相互作用、妊娠中または授乳中の女性への使用に関する情報、生殖能力、運転および機械の操作に関する情報、および賦形剤の警告。
製品の服用方法または使用方法
投与量、投与方法および投与経路、投与頻度、適切な使用方法、治療期間、過剰投与、薬の不規則な使用、
起こりうる副作用
副作用の説明、小児および青少年における追加の副作用。
商品名の保存方法
保管中および保管条件には特別な指示と注意が必要です。
詳細情報
有効成分および賦形剤の情報、薬剤形態、容器の性質および内容、販売認可保有者およびバッチリリースの責任者である製造業者の名前と住所、PIL の改訂日、および副作用を報告するための国家当局の住所。
販売承認保有者情報
氏名と住所
メーカー情報
氏名と住所
このリーフレットは最後に改訂されました
日付: 月と年
副作用を報告する
このセクションに、すべての医薬品安全性監視および QPPV情報と報告方法に関する指示を追加します。
医療機器のラベル
医療機器に関するSFDA表示要件 包装材料、ラベル、使用説明書(IFU)に適用され、医療機器登録申請(MDMA)でそれに応じて提出する必要があります。低リスクの医療機器と低リスクの医療機器の両方に適用されます。 および高リスクの医療機器。
「ラベリング」という用語は、以下を含む総称です。
- ラベル、
- 使用説明書(操作マニュアルと呼ばれることもあります)
- 医療機器の識別、技術的説明、使用目的、適切な使用に関連するその他の情報
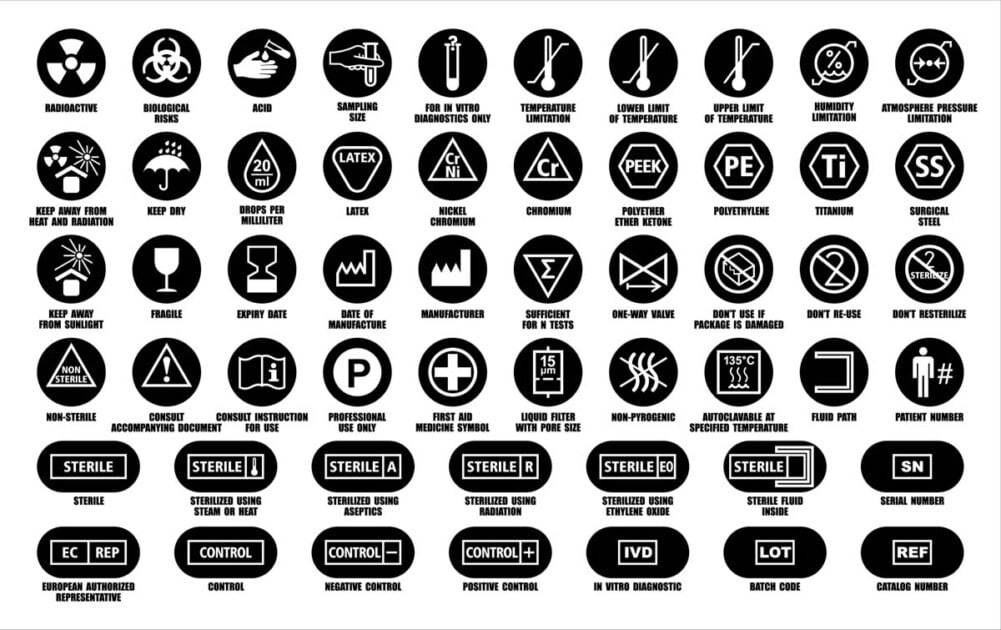
ラベルという用語は、次のような内容の書かれた、印刷された、またはグラフィックの情報を表します。
- 医療機器自体に貼り付けられているか表示されているもの(電子ディスプレイを含む)
- パッケージについて:
- 各ユニット(包装)
- 複数のデバイス(コンテナ)
- 添付文書(医療機器自体にラベルを直接貼り付けることが非現実的または不適切である場合に使用されます。非現実的とは、物理的な制約によりこれが不可能な場合を意味します)。
ラベル付けの主な目的は次のとおりです。
- 医療機器とその製造元を特定する。
- デバイスの用途と性能について説明します。
- デバイスの使用方法、保守方法、保管方法を説明し、
- 残存するデバイスのリスク、警告、制限、禁忌に関する情報を提供します。
使用説明書(IFU)
「使用説明書(IFU)」とは、製造元がデバイスのユーザーに通知するために提供する情報を意味します。
- 医療機器の本来の目的と適切な使用について。
- 取るべき予防措置について。
使用説明書がなくても製造元の意図どおりに安全に使用できるデバイスの場合、IFU は不要であるか、または省略されることがあります (光学レンズ、歩行杖、または単純な創傷被覆材など)。
ラベル言語
医療機器のユーザーが以下の場合:
- 専門的に資格がある可能性が高いため、ラベルは英語で記載する必要があります。
- 一般の方向けに、ラベルとIFUは可能な限りアラビア語と英語で記載してください。それが不可能な場合は、ラベルとIFUで使用する言語はアラビア語としてください。
どちらの場合も、テキストは、対象ユーザーの技術的知識、経験、教育、またはトレーニングに応じて、対象ユーザーが容易に理解できる用語で記述する必要があります。
メーカーの説明書の言語
医療機器の取り扱い、保管、輸送、設置、保守、および廃棄に関する説明書は、英語で作成され、正当な理由がある場合はアラビア語でも作成されなければならない。医療資格を持たない者がこれらの作業を行う場合、説明書は、想定される使用者の技術的知識、経験、教育、または訓練に応じて、容易に理解できる言葉で書かれなければならない。機器が一般人向けに設計されている場合、医療機器の取り扱い、保管、輸送、および保守に関する説明書は、アラビア語と英語で作成されなければならない。
ラベルの媒体
ラベルは人間が読める形式で提供される必要がありますが、無線周波数識別 (RFID) やバーコードなどの機械が読める形式で補足することもできます。
ラベルの内容
デバイス名
製品の商品名またはブランド名はラベルに印刷する必要があります。同様に、製品の型番もラベルに印刷されます。
製造業者の名称と住所
製造業者の名称と住所はラベルに記載する必要があり、提出されたAR契約書およびその後のARライセンスに記載されている住所情報と一字一句一致している必要があります。住所情報に不一致がある場合、提出された申請書はSFDAに差し戻され、医療機器販売承認の取得に支障をきたす可能性があります。
OEM / OBL ケースにおける合法的な製造業者
OEM は Original Equipment Manufacturer の略語であり、OBL は Own Brand Labelling の略語です。
OEM / OBLの場合、MDMA申請の根拠としてEU管轄が選択されている場合、 SFDAラベルの「製造業者シンボル」の横に記載されている製造業者名を法的製造業者とみなします。該当しない場合は、以下の書類をSFDAに提出する必要があります。
- 使用された適合性評価ルートに基づく適合性評価証明書のコピー(CE 証明書、DE 証明書、生産品質保証証明書など)
- 製品の「適合宣言書」のコピー。
- ラベルのコピー(使用説明書を含む)
- 最新の監査報告書(該当する場合)
電源
デバイスが AC 電源に接続されている場合、製品が設計されている公称周波数 (60 ヘルツ) と電圧値およびその許容範囲を示します。
IVDラベル
これは、製品が体外診断用医療機器である場合、その製品が体外診断用であることを示します。
保管条件
該当する場合は、適用される特別な保管および取り扱い条件を示します。
警告または注意事項
警告、注意事項、制限事項、禁忌事項。
バッチ番号またはロット番号
バッチコード/ロット番号またはシリアル番号により、製品の追跡またはリコールが必要な場合に市販後のコンプライアンス措置を適用できます。ただし、IVD医療機器の付属品の場合は管理番号に置き換えることができ、ソフトウェアの場合はバージョン番号に置き換える必要があります。
有効期限
該当する場合、製品を安全に使用できる期限を明確に示します(例:滅菌済みまたは使い捨ての製品の場合)。
量
該当する場合、内容物の正味量は、重量または容積、数値、またはこれらの組み合わせ、あるいはパッケージの内容物を正確に反映するその他の用語で表されます。
単回使用または複数回使用
製品が使い捨てである場合は、その旨の表示。



