
Informazioni sull'autore
Redattore normativo
Pubblicato dal team degli affari normativi di PharmaKnowl, ufficio di Riyadh.
SFDA richiede a tutte le aziende produttrici di dispositivi medici in Arabia Saudita di conformarsi alle normative sull’identificazione univoca dei dispositivi (UDI). Devono registrare le informazioni UDI dei loro prodotti nel sistema UDI SFDA . Le normative vengono applicate gradualmente in base alla classe di rischio del dispositivo e possono essere presentate solo tramite rappresentanti autorizzati in Arabia Saudita.
Sommario
Che cosa è l’UDI?
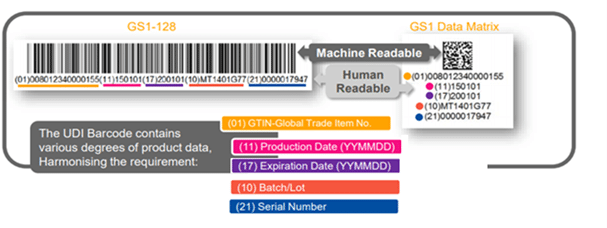
Identificazione Univoca del Dispositivo (UDI) L’UDI è una serie di caratteri numerici o alfanumerici generati tramite un sistema di codifica accettato a livello globale. Si tratta di un identificatore che identifica in modo univoco un dispositivo durante la sua distribuzione e il suo utilizzo. È composto da due parti:
1. Un identificatore di dispositivo (DI): una parte obbligatoria e fissa di un UDI che identifica il numero di prodotto specifico di un dispositivo e l’etichettatore di tale dispositivo e
2. Un identificatore di produzione (PI): una parte variabile e condizionale di un UDI che identifica uno o più dei seguenti elementi quando incluso sull’etichetta del dispositivo:
- Il lotto o la partita in cui è stato fabbricato un dispositivo.
- Il numero di serie di un dispositivo specifico.
- La data di scadenza di un dispositivo specifico.
- La data di fabbricazione di un dispositivo specifico.
L’UDI deve essere apposto sull’etichetta del dispositivo e sui livelli superiori dei materiali di imballaggio e deve essere presentato in due forme:
- Testo semplice facilmente leggibile (noto anche come HRI-Human Readable Interpretation) e
- Tecnologia AIDC (Identificazione Automatica e Acquisizione Dati).
Codice a barre UDI: cosa c’è sull’etichetta?
Ambito
- Tutti i dispositivi medici e i relativi accessori, ad eccezione di quelli realizzati su misura per pazienti specifici e dei dispositivi per uso sperimentale e di ricerca
- Produttori, rappresentanti autorizzati
Agenzie di emissione riconosciute
Gli enti emittenti riconosciuti dall’UDI sono le seguenti entità: GS1, HIBCC e ICCBBA.
Banca dati UDI
- Il fabbricante o il suo rappresentante autorizzato deve presentare e conservare i dati appropriati nella banca dati UDI.
- Deve essere controllato e sottoposto a manutenzione periodica da parte del produttore
- I dati per il nuovo UDI-DI devono essere disponibili nella banca dati al momento dell’immissione del dispositivo sul mercato.
- Tutti i dati specificati (non privati) nel database saranno accessibili al pubblico.
- Tutti i dati in GHAD e Saudi-DI, come il nome del modello e il codice GMDN, sono accurati e validi.
PERCHÉ UDI?
Il sistema UDI della SFDA mira a standardizzare l’identificazione dei dispositivi medici (e dei relativi accessori). Il sistema UDI mira ad aumentare la sicurezza dei pazienti e a ottimizzare l’assistenza facilitando quanto segue:
Aumentare la sicurezza dei pazienti
- Aumentare la sicurezza del paziente: nelle segnalazioni di eventi avversi e in altre attività di sorveglianza post-commercializzazione, azioni correttive di sicurezza sul campo.
- Migliorare l’identificazione e la tracciabilità: controllo nei porti e durante il ciclo di vita, identificazione e documentazione nel punto di utilizzo sul paziente.
- Identificazione delle contraffazioni.
- Utilizzo sicuro ed efficace dei dispositivi e riduzione degli errori medici.
- Cartelle cliniche elettroniche dei pazienti.
Utilizzato in altri aspetti
- Gestione degli acquisti e dell’inventario
- Attività di assicurazione medica
- Controllo e monitoraggio dei costi
- Sostituire la codifica interna con UDI
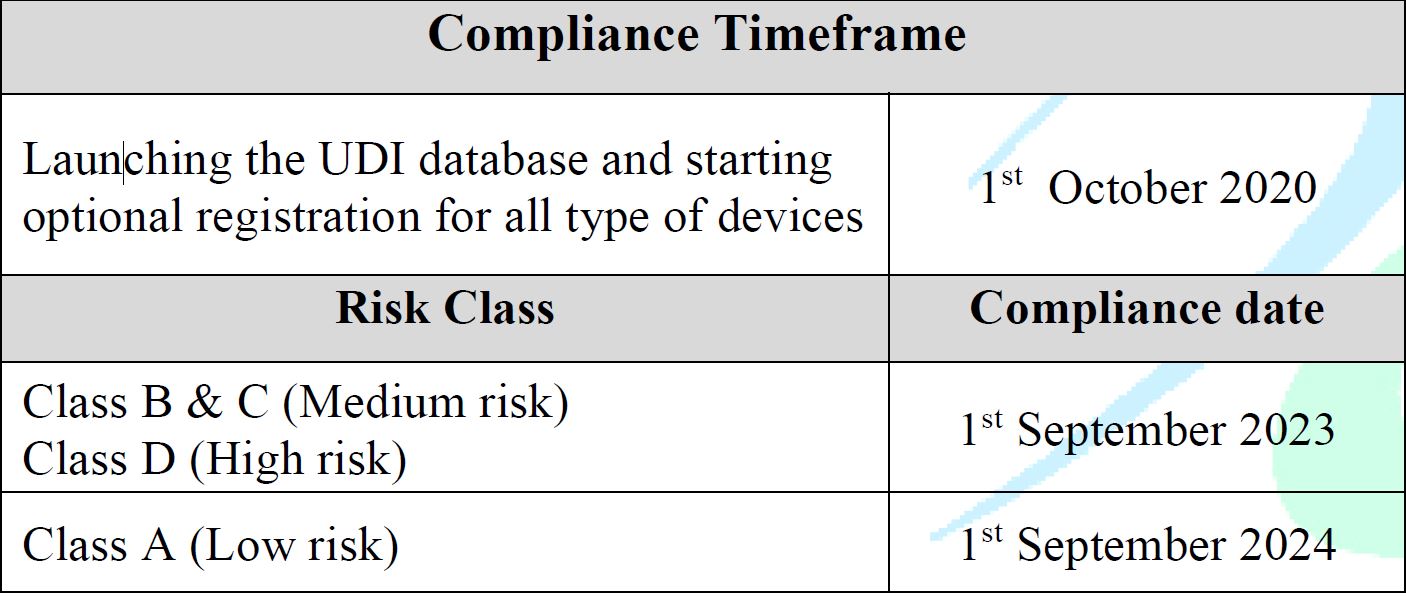
Date di efficacia
- In vigore dal 1° ottobre 2020
Lancio del database UDI e avvio della registrazione facoltativa per tutti i tipi di dispositivi. - Il piano di applicazione si baserà sulla classe di rischio del prodotto come segue:
- Rischio elevato (D): 1 settembre 2023
- Rischio medio (B, C): 1 settembre 2023
- Basso rischio (classe A): 1 settembre 2024
Chi può registrare l’UDI?
Solo i rappresentanti autorizzati in Arabia Saudita possono accedere alla piattaforma UDI SFDA . Contattaci per assistenza.
Per saperne di più:



