
关于作者
監管編輯
由 PharmaKnowl 利雅德辦事處的監管事務團隊發佈。
SFDA 要求沙特阿拉伯的所有医疗器械公司遵守唯一器械标识 (UDI) 法规。他们必须在 SFDA UDI 系统中注册其商品的 UDI 信息。这些法规根据设备风险等级逐步执行,并且只能通过沙特阿拉伯的 授权代表 提交。
什么是 UDI?
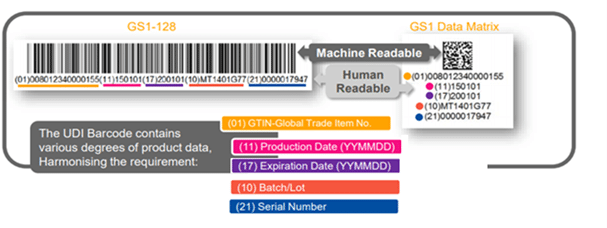
唯一设备标识 UDI 是通过全球公认的编码系统生成的一系列数字或字母数字字符。它是一个标识符,通过设备的分发和使用明确地标识设备。由两部分组成:
1. 设备标识符 (DI): UDI 的强制性固定部分,用于标识设备的特定产品编号和该设备的贴标机,以及
2. 生产标识符 (PI): UDI 的有条件可变部分,当包含在器械标签上时,用于标识以下一项或多项:
- 制造设备的批次或批次。
- 特定设备的序列号。
- 特定设备的到期日期。
- 特定设备的制造日期。
UDI 应贴在器械的标签和更高级别的包装材料上,并以两种形式呈现:
- 易于阅读的纯文本(也称为 HRI-人类可读解释),以及
- AIDC 技术(自动识别和数据捕获)。
UDI 条形码 – 标签上有什么?
范围
- 所有医疗器械及其附件,为特定患者定制的设备以及研究和研究用设备除外
- 制造商、授权代表
认可发行机构
UDI 认可的发证机构包括以下实体: GS1、HIBCC 和 ICCBBA。
UDI 数据库
- 制造商或其授权代表应在 UDI 数据库中提交并维护适当的数据。
- 应由制造商定期检查和维护
- 当设备投放市场时,新 UDI-DI 的数据应在数据库中可用。
- 数据库中的所有指定(非私有)数据都将公开可用。
- GHAD 和 Saudi-DI 中的所有数据(例如型号名称和 GMDN 代码)都是准确有效的。
为什么选择 UDI?
SFDA 的 UDI 系统旨在标准化医疗器械标识(及其附件)。UDI 系统旨在通过促进以下方面来提高患者安全并优化患者护理:
提高患者安全性
- 提高患者安全性:在不良事件报告和其他上市后监测活动中,现场安全纠正措施。
- 提高识别和可追溯性:在端口及其生命周期内进行控制,在患者使用点进行识别和记录。
- 假冒产品的识别。
- 安全有效地使用设备并减少医疗错误。
- 患者的电子健康记录。
用于其他方面
- 采购和库存管理
- 医疗保险活动
- 成本控制和监控
- 用 UDI 取代内部编码
生效日期
- 自 2020 年 10 月 1 日起生效
启动 UDI 数据库并启动所有类型的设备的可选注册。 - 强制措施计划将基于商品的风险等级,如下所示:
- 高风险 (D):2023 年 9 月 1 日
- 中等风险(B、C):2023 年 9 月 1 日
- 低风险(A 类):2024 年 9 月 1 日

谁可以注册 UDI?
只有沙特授权的代表才能访问 SFDA UDI 平台。 联系我们 以获得支持。
閱讀更多:



