
关于作者
監管編輯
由 PharmaKnowl 利雅德辦事處的監管事務團隊發佈。
SFDA 对标签和包装有严格的要求,公司在 SFDA 产品注册过程中必须遵守这些要求。获得批准后,不得更改标签信息,即使是最低限度的更改,以保持商品合规性并避免货件被拒收或退出市场。
本文将回顾药品和医疗器械的贴标要求。
目录
药品标签
必须对所有药品说明书组件(包括纸箱、标签、铝箔、说明书说明书)(患者信息说明书 PIL)和商品特性摘要 SPC 适用特定的 SFDA 贴标要求。我们将在此处概述上述每个组成部分的高级要求,因为它们是 沙特阿拉伯领先的药品注册要求之一。
外包装和内包装(二次包装)
医药商品名称
商品描述应显示在盒子的六个面中的三个以上非相对面上。它应该用英语和阿拉伯语书写。
活性物质的声明
活性物质的表达应按剂量单位定性和定量表示。它应该用英语和阿拉伯语书写。
指示声明
包装上应突出显示产品指示。例如,用于治疗、预防等
辅料清单
具有公认作用或作用的辅料应定性表示。如果医药商品是肠外、外用、眼部制剂或用于吸入,则必须注明所有辅料。
药物形式和内容物
内容物应按重量、体积、剂量数或给药单位数(例如,10 片、100 mL 等)提及。
给药方法和途径
应明确说明正确使用医药产品的给药方法和说明,例如“使用前请摇匀。有关使用说明,可参考(见随附的说明书)
特别警告
标签上应突出显示特殊警告,例如“避免阳光照射,放在儿童看不见和接触不到的地方,仅供外部使用。
储存条件
应提及商品的储存条件,例如,在 250°C 以下储存或储存在 300 °C 以下。对于多剂量商品,应增加使用稳定性,例如,首次开封后的保质期应为一个月、两个月、三个月等。它必须反映 SFDA 稳定性研究中的规定。
制造商和 MAH
应提及制造商和上市许可持有人的姓名和地址。
泡罩或条状物(初级包装)
医药商品名称
商品的名称和强度应显示在每个泡罩口袋上;如果凹槽太小,则应在整个条带上以模式重复信息。要求提供英语和阿拉伯语版本,这是所有部件的强制性 SFDA 贴标要求。
上市许可持有人的姓名
仅品牌名称就足够了。
制造和有效期
日期应表示为,例如 02/2010 或 Feb 2010。
批号
批号和有效期应位于每个泡罩条的末尾。
产品特性 SPC 总结
虽然 SPC 或 SmPC 未打印并随药品附上,但必须适用 SFDA 标签要求。只有经批准的 SmPC 才能分发给从业员并用于宣传材料。
主要信息
药品名称、浓度和药物形式。
定性和定量组成
活性物质应以每单位剂量表示。辅料应包括标准声明,例如,“有关辅料的完整列表,请参阅”辅料清单“部分。
药物形式
应提及产品剂型,例如薄膜包衣片、缓释片等,以及剂型说明。如果片剂设计有评分线,则应提供有关它是否有助于打破或将药丸分成相等剂量的信息。
临床详情
治疗适应症
适应症应定义治疗或预防的目标疾病或病症及其在成人、新生儿、婴儿、儿童和年龄(月、岁)青少年中的适应症。
剂量学和给药方法
在适当的情况下,应为每个类别的每个剂量间隔指定剂量推荐(适当确定人群子集的年龄/体重/体表面积)。应提供老年患者、肾功能损害、肝功能损害和儿科人群等特殊人群的信息。此外,还应提供处理和管理产品的预防措施。
禁忌
在这些情况下,出于安全原因,即对活性物质或任何赋形剂过敏,不得提供医药产品。
特别警告和使用注意事项
有关特定风险、特定风险最小化措施、不良反应、安全信息的信息、
相互 作用
临床相互作用研究(体内),药效学相互作用,药代动力学相互作用。
生育能力、怀孕和哺乳期
对于孕妇和哺乳期妇女以及有生育能力的女性,应根据 临床试验、非临床研究和药理活性推荐使用。
对驾驶和使用机器的能力的影响
不良影响
安全性概况、不良反应和报告任何副作用的国家当局地址摘要。
过量
意外、错误或自杀未遂服用不同剂量水平的效果。
药理特性
内容物应按重量、体积、剂量数或药品给药单位数(例如,10 片、100 mL 等)提及。
药品详情
- 辅料清单
- 不兼容
- 保质期
- 储存的特殊注意事项
- 容器的性质和内容物。
处置和处理的特殊预防措施
对处置有特殊要求的,若非“无特殊要求”可提及。处置应根据当地要求进行。
上市许可持有人
上市许可编号
首次授权/授权续期日期
文本修订日期
患者信息传单 (PIL)
(发明名称)是什么,以及它的用途
发明的名称、强度、药物形式、活性成分、治疗适应症和使用这种药物的好处。
服用或使用产品之前
禁忌症、适当的使用注意事项/特别警告、与其他药物/食物/饮料的相互作用、孕妇或哺乳期妇女的使用信息、生育能力、驾驶和使用机器的信息以及赋形剂的警告。
如何服用或使用产品
剂量、给药方法和途径、给药频率、正确使用说明、治疗持续时间、过量、不规则用药、
可能的副作用
描述儿童和青少年的副作用、其他副作用。
如何存储产品名称
在储存和储存条件下需要特别的说明和预防措施。
更多信息
活性物质和辅料信息、药物形式、容器的性质和内容物、上市许可持有人和负责批次放行的制造商的名称和地址、PIL 的修订日期以及报告任何副作用的国家当局地址。
上市许可持有人信息
姓名和地址
制造商信息
姓名和地址
本说明书最后修订于
日期:月和年
报告任何副作用
在此部分下添加 所有 药物警戒和 QPPV 信息和说明,以报告。
医疗器械标签
SFDA 标签要求 适用于包装材料、标签和使用说明 (IFU),并且必须在 医疗器械注册 申请 (MDMA) 中提交相应的说明。它们适用于低风险 以及高风险医疗器械。
标签一词是一个统称,包括:
- 标签
- 使用说明(有时称为作手册),以及
- 与医疗器械的身份、技术描述、预期目的和正确使用相关的任何其他信息,
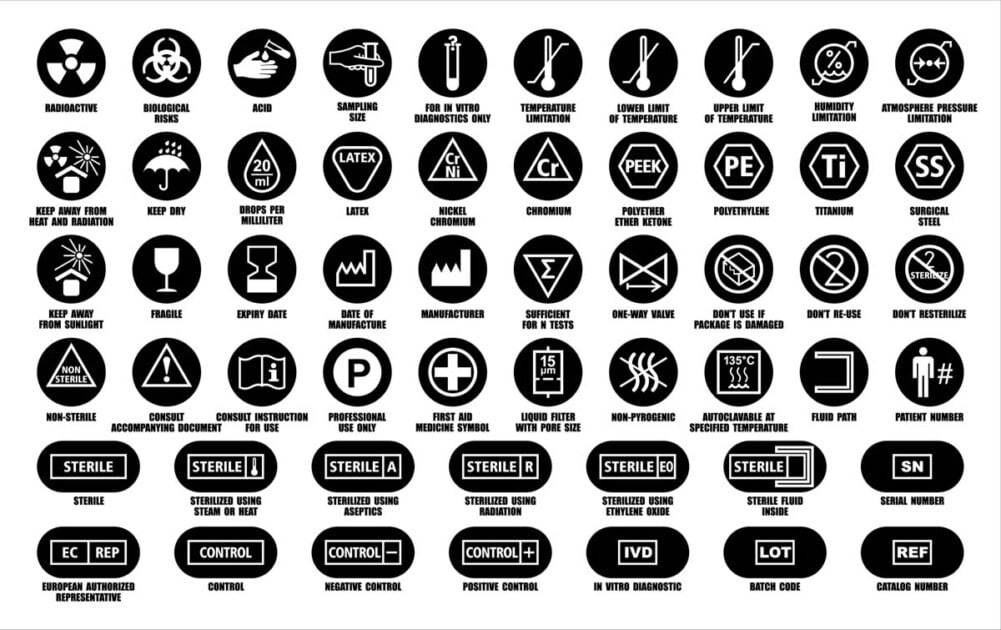
术语 标签 描述书面、印刷或图形信息,这些信息是:
- 贴在或出现在医疗器械本身(包括电子显示器)上
- 关于包装:
- 每件商品(包装纸)
- 多个设备(容器)
- 在包装说明书上(用于将标签直接贴在医疗器械本身上不切实际或不适当的地方。不切实际的是指物理限制阻止这种情况发生的地方)。
贴标的主要目的是:
- 确定医疗器械及其制造商,
- 描述设备的预期用途和性能,
- 描述应如何使用、维护和存放设备,以及
- 提供有关任何残留设备风险、警告、限制或禁忌症的信息。
使用说明 (IFU)
术语“使用说明 (IFU)”是指制造商为通知设备用户而提供的信息:
- 医疗器械的预期用途和正确使用。
- 需要采取的任何预防措施。
如果设备可以安全使用并按照制造商的意图使用,而无需任何此类使用说明(例如,光学镜片、手杖或简单的伤口敷料),则可能不需要 IFU 或缩写器械。
标签语言
医疗器械的用户是:
- 标签可能具有专业资格,应使用英文。
- 外行人,标签和 IFU 应在可行的情况下使用阿拉伯语和英语。如果不可行,标签和 IFU 中使用的语言应为阿拉伯语。
在这两种情况下,文本应以目标用户易于理解的术语编写,并与他们的技术知识、经验、教育或培训相称。
制造商说明的语言
医疗器械的处理、储存、运输、安装、维护和处置说明应使用英文,如有正当理由,应使用阿拉伯语。文本应以预期用户易于理解的术语编写,并与其技术知识、经验、教育或培训相称,没有医疗资格的人可以从事此类工作。如果器械是为非专业人士设计的,则处理、储存、运输和维护医疗器械的说明应使用阿拉伯文和英文。
贴标介质
标签应以人类可读的格式提供,但可以辅以机器可读的形式,例如射频识别 (RFID) 或条形码。
标签内容
设备名称
标签上应印有商品、商标或品牌名称。同样,产品型号也印在标签上。
制造商的名称和地址
制造商的名称和地址必须印在标签上,并且必须将收到的 AR 协议和后续 AR 许可中提到的地址详细信息逐个字母匹配。地址详细信息的任何差异都会导致提交的申请退回给 SFDA ,从而在获得医疗器械营销授权时造成复杂性。
OEM/OBL 案件中的合法制造商
OEM 是 Original Equipment Manufacturer 的缩写,而 OBL 是 Own Brand Labelling。
在 OEM/OBL 案件中,如果欧盟司法管辖区已被选为 MDMA 申请的基础, SFDA 将标签上“制造商符号”旁边的制造商名称视为合法制造商。如果这不适用,则应向 SFDA 提交以下文件:
- 基于所用合格评定途径的合格评定证书复印件(即 CE 证书、DE 证书、生产质量保证证书……等)
- 产品副本“符合性声明。
- 标签复印件(包括使用说明)
- 最近的审计报告(如果适用)
电源
当设备连接到交流电源时,指示标称频率(60 赫兹)和电压值及其产品设计所针对的公差。
IVD 标签
这表明,如果商品是 IVD 医疗器械,则用于体外诊断。
储存条件
在适用的情况下,说明适用的任何特殊储存和处理条件。
警告或注意事项
任何警告、预防措施、限制或禁忌症。
批次或批号
如果需要追踪或 召回 产品,可以使用批号/批号或序列号采取上市后合规措施。但是,对于 IVD 医疗器械的附件,可以用控制号代替,对于软件,应用版本号代替。
有效期
明确说明商品可以安全使用的截止日期(例如,在无菌或一次性用品上)。
数量
在相关情况下,内容物净含量的指示以重量或体积、数量或准确反映包裹内容物的这些或其他术语的任意组合表示。
单次或多次使用
如果商品是一次性使用的,则表明该事实。



