
著者について
規制編集者
PharmaKnowl リヤド オフィスの規制業務チームによって発行されました。
SFDA、サウジアラビアのすべての医療機器企業に対し、固有機器識別(UDI)規制の遵守を義務付けています。企業は、 SFDAUDIシステムに製品のUDI情報を登録する必要があります。この規制は機器のリスククラスに基づいて段階的に施行され、サウジアラビア国内の認定代理人を通じてのみ申請できます。
目次
UDIとは何ですか?
固有機器識別番号(UDI)は、世界的に認められたコード体系に基づいて生成された、数字または英数字からなる一連の文字列です。機器の流通および使用において、機器を一意に識別する識別子です。以下の2つの部分から構成されます。
1. 機器識別子(DI):機器の特定の製品番号とその機器のラベル製造者を識別するUDIの必須の固定部分であり、
2. 製造識別子 (PI):デバイスのラベルに記載されている場合に、次の 1 つ以上の項目を識別する UDI の条件付き可変部分。
- デバイスが製造されたロットまたはバッチ。
- 特定のデバイスのシリアル番号。
- 特定のデバイスの有効期限。
- 特定のデバイスの製造日。
UDI は機器のラベルおよび梱包材の上位層に記載され、次の 2 つの形式で提示されます。
- 簡単に読めるプレーンテキスト(HRI-Human Readable Interpretationとも呼ばれる)
- AIDC テクノロジー (自動識別およびデータ キャプチャ)。
UDI バーコード – ラベルには何が記載されていますか?
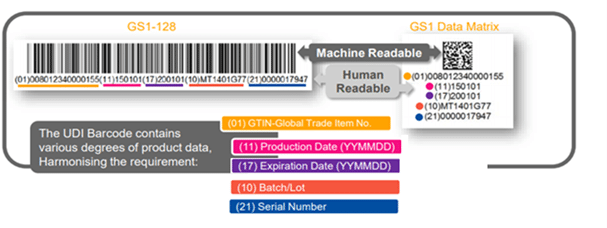
範囲
- 特定の患者向けにカスタムメイドされた機器、研究用機器、調査用機器を除くすべての医療機器とその付属品
- メーカー、正規代理店
認定発行機関
UDI 認定の発行機関は、GS1、HIBCC、ICCBBA です。
UDI データベース
- 製造業者またはその認定代理人は、UDI データベースに適切なデータを提出し、維持するものとします。
- 製造業者による定期的な点検とメンテナンスが必要である
- 新しい UDI-DI のデータは、デバイスが市場に投入された時点でデータベースで利用可能になります。
- データベース内の指定されたすべての(非プライベートな)データは公開されます。
- モデル名やGMDNコードなど、GHADおよびSaudi-DIのすべてのデータは正確かつ有効です。
なぜUDIなのか?
SFDAのUDIシステムは、医療機器(およびその付属品)の識別を標準化することを目的としています。UDIシステムは、以下の事項を促進することで、患者の安全性を高め、患者ケアを最適化することを目指しています。
患者の安全性の向上
- 患者の安全性の向上: 有害事象報告やその他の市販後調査活動において、安全性に関する是正措置を実施します。
- 識別と追跡可能性の向上: 港での管理、ライフサイクル中の管理、患者の使用時点での識別と文書化。
- 偽造品の識別。
- 機器の安全かつ効果的な使用と医療ミスの削減。
- 患者の電子健康記録。
他の面でも活用
- 購買と在庫管理
- 医療保険業務
- コスト管理と監視
- 社内コーディングをUDIに置き換える
有効日
- 2020年10月1日より有効
UDI データベースを起動し、すべてのタイプのデバイスのオプション登録を開始します。 - 施行計画は、製品のリスククラスに基づいて次のように決定されます。
- 高リスク(D):2023年9月1日
- 中リスク(B、C):2023年9月1日
- 低リスク(クラスA):2024年9月1日

UDI を登録できるのは誰ですか?
SFDA UDIプラットフォームにアクセスできるのは、サウジアラビアの認可を受けた担当者のみです。サポートについてはお問い合わせください。
続きを読む:



