
Acerca del autor
Krishna Sravya
Regulatory Affairs Specialist (M.Pharm) at PharmaKnowl, focused on SFDA compliance and intelligence for Pharma and MedTech.
El Programa de Acceso Especial (PAE), implementado por la Autoridad Saudita de Alimentos y Medicamentos (SFDA), permite a los pacientes acceder a medicamentos no registrados en casos urgentes o potencialmente mortales. El programa garantiza que los pacientes con necesidades médicas no satisfechas puedan acceder al tratamiento, incluso si la aprobación del medicamento aún no se ha otorgado en Arabia Saudita.
Tabla de contenido
Introducción a SAP
Los pacientes que cumplen con ciertos requisitos de elegibilidad pueden utilizar medicamentos, productos biológicos y artículos médicos no registrados en el SAP. Esto se aplica únicamente a problemas médicos muy especiales y en los siguientes casos:
- El paciente padece una enfermedad grave o potencialmente mortal.
- No hay productos médicos alternativos registrados disponibles localmente.
- El producto no registrado ha demostrado evidencia de eficacia y seguridad.
El SAP se limita a productos farmacéuticos y sanitarios. No cubre dispositivos médicos ni productos veterinarios.
Deberes y roles
La SFDA
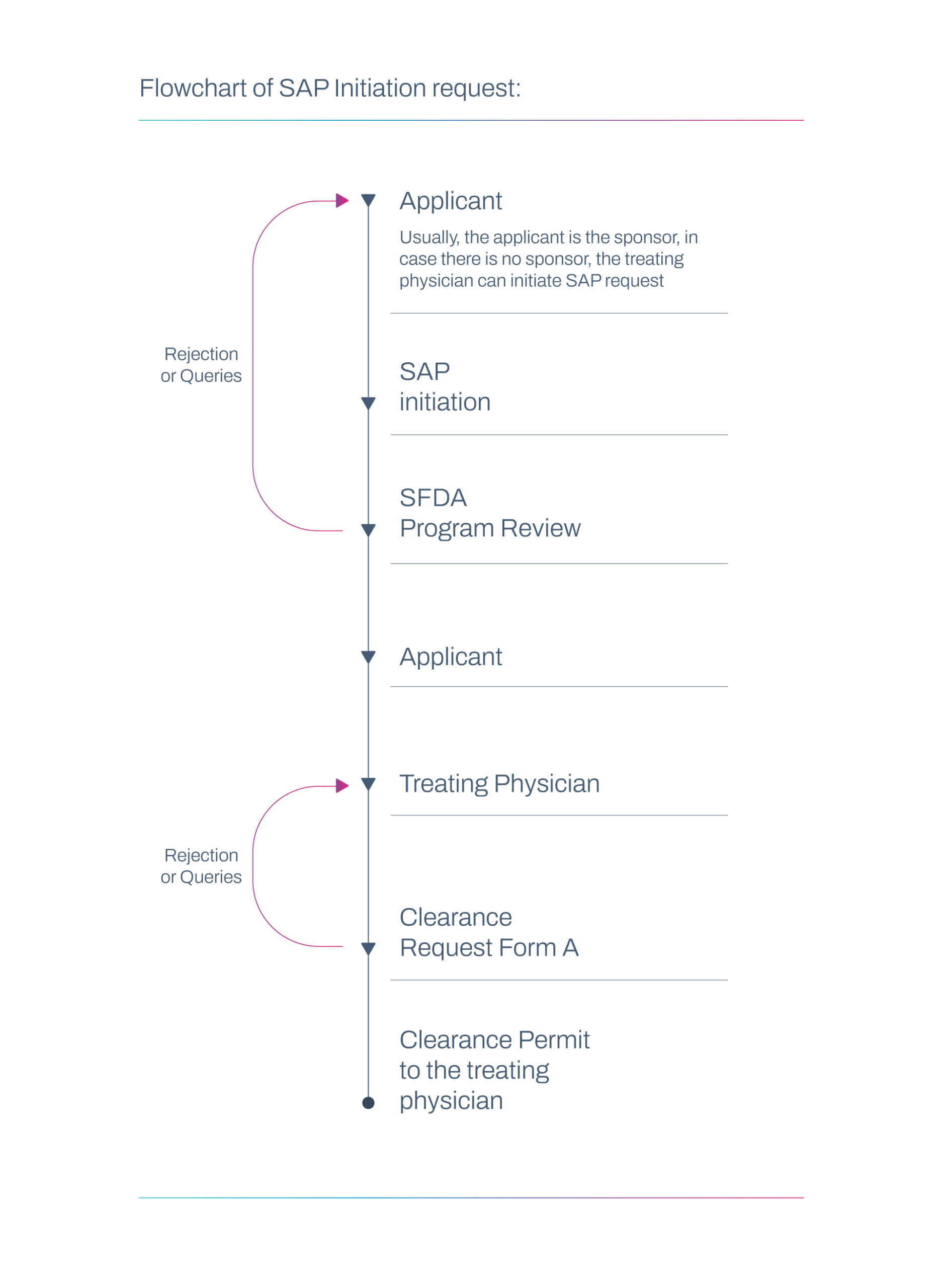
- Recibe y revisa las solicitudes de SAP enviadas por los médicos tratantes o patrocinadores.
- Dependiendo de la evaluación, la SFDA puede aprobar la solicitud, solicitar datos adicionales o emitir un rechazo.
- Emite permisos de importación para medicamentos aprobados, garantizando la importación legal y notificando a las autoridades pertinentes.
- Es importante destacar que la SFDA no evalúa exhaustivamente la seguridad ni la eficacia del medicamento; esta responsabilidad recae en el médico tratante .
Médico tratante
- Inicia la solicitud SAP en ausencia de alternativas adecuadas.
- El médico también debe presentar documentos detallados como la justificación de la historia clínica, el protocolo de tratamiento y el plan de seguimiento.
- El médico tratante debe obtener el consentimiento informado del paciente o tutor, según las pautas del ICH.
- Informa todos los eventos adversos y rinde cuentas por el uso del producto a SFDA y al patrocinador.
- Los médicos deben informar los eventos adversos de acuerdo con los requisitos de farmacovigilancia y QPPV .
Patrocinador/Fabricante
- El patrocinador proporciona documentos clave del producto, incluido el folleto del investigador y la información de prescripción.
- Garantiza el cumplimiento de las leyes de exportación de su propio país.
- El patrocinador también puede enviar la solicitud SAP directamente si participa en el proceso.
- Como responsabilidad final, el Patrocinador debe garantizar que todos los documentos relacionados con SAP sean completos, precisos y cumplan con las regulaciones de la SFDA.
Ruta de aplicación de SAP
En ocasiones, un médico tratante autorizado o el patrocinador/fabricante pueden presentar la solicitud SAP. Cuando no interviene ningún patrocinador, el médico tratante podrá presentar la solicitud de SAP solo.
Requisitos de preaprobación
Para iniciar la solicitud, estos documentos deben enviarse al Vicepresidente Ejecutivo de Asuntos de Drogas de la SFDA:
- Carta de presentación firmada con membrete en árabe (dirigida oficialmente) .
- Protocolo SAP , que debe incluir:
- Justificación del uso del fármaco en investigación.
- Resumen de la condición del paciente, historial médico e intentos de tratamiento previos.
- Dosificación, forma de administración y duración del tratamiento.
- Métodos de seguimiento y evaluación de la seguridad.
- Documentación adicional del producto (por ejemplo, información de prescripción extranjera).
- Folleto del investigador que detalla:
- Formulación y estructura del fármaco.
- Datos farmacológicos y toxicológicos.
- Resultados de ensayos clínicos relevantes para la seguridad y la eficacia.
- Riesgos conocidos, efectos secundarios y precauciones necesarias.
- Formulario de Consentimiento Informado , el cual deberá:
- Indique claramente que el paciente participa en SAP de forma voluntaria.
- Describa la duración y los objetivos del programa.
- Describa los procedimientos, los riesgos y los beneficios potenciales.
- Incluya información de contacto para que los pacientes puedan hacer preguntas o informar eventos adversos.
Los patrocinadores de productos designados o excepcionales deberían explorar opciones aceleradas, como la designación de medicamento huérfano o de producto innovador .
Requisitos posteriores a la aprobación
Luego de la aprobación, el médico deberá presentar los siguientes documentos para la autorización del producto.
- Carta de presentación oficial con membrete en árabe de la institución beneficiaria.
- Formulario de solicitud SAP completado y firmado por el médico .
- Copia del consentimiento informado firmado (por el paciente o tutor legal) según los requisitos del ICH.
- Cualquier documento adicional solicitado por la SFDA.
Flujo de trabajo de solicitud de SAP
Obligaciones de información
Informes de seguridad
- Los SUSAR deben reportarse mediante el formulario CIOMS (Consejo de Organizaciones Internacionales de Ciencias Médicas) y el solicitante debe enviarlos en formato XML. Sin embargo, los médicos tratantes pueden estar exentos del requisito de presentación en XML.
- SUSAR fatales o potencialmente mortales: dentro de los 7 días
- Otros SUSAR: dentro de los 15 días
Informes de progreso
- Presentar informes de estado cada 3 meses o según lo solicite la SFDA.
- En particular, los informes deberán incluir:
- Desviaciones del protocolo
- Riesgos adicionales o preocupaciones de seguridad
- Reacciones adversas graves a medicamentos (RAM)
- Información de seguridad emergente
Liquidación de productos
Después de la aprobación de la SFDA, el patrocinador o el hospital reciben una carta de importación para despachar el producto en la aduana saudí”.
Notas importantes sobre cumplimiento
- En particular, queda estrictamente prohibida la publicidad o promoción de productos bajo SAP.
- SAP es solo para uso de pacientes designados y no sustituye los ensayos clínicos formales ni las vías de autorización de comercialización.
- Para terapias génicas o celulares, la aprobación de SAP por sí sola podría no ser suficiente. Los patrocinadores deben consultar los marcos CAR-T / ATMP de la SFDA para conocer los requisitos específicos de clasificación, BPM y datos.
Soporte de registro
En PharmaKnowl Consulting, nos especializamos en servicios de consultoría regulatoria adaptados a las vías de la SFDA. Nuestros expertos brindan asesoramiento estratégico sobre las solicitudes del Programa de Acceso Especial (PAE), desde la evaluación de elegibilidad hasta la planificación de la documentación, garantizando la conformidad con los requisitos de la SFDA.
Póngase en contacto con PharmaKnowl hoy mismo para optimizar su recorrido hacia SAP.



