
Über den Autor
Krishna Sravya
Regulatory Affairs Specialist (M.Pharm) at PharmaKnowl, focused on SFDA compliance and intelligence for Pharma and MedTech.
Das Special Access Program (SAP), das von der saudischen Lebensmittel- und Arzneimittelbehörde (SFDA) eingeführt wurde, ermöglicht Patienten in dringenden oder lebensbedrohlichen Fällen den Zugang zu nicht registrierten Medikamenten. Dieses Das Programm stellt sicher, dass Patienten mit ungedecktem medizinischem Bedarf Zugang zu einer Behandlung erhalten, auch wenn die Arzneimittelzulassung in Saudi-Arabien noch nicht erteilt wurde.
Inhaltsverzeichnis
SAP-Einführung
Einzelne Patienten, die bestimmte Anspruchsvoraussetzungen erfüllen, können im Rahmen des SAP-Programms nicht registrierte Arzneimittel, Biologika und medizinische Artikel nutzen. Dies gilt nur für sehr spezielle medizinische Probleme und nur für Fälle, in denen:
- Der Patient leidet an einer schweren oder lebensbedrohlichen Erkrankung.
- Es sind vor Ort keine alternativen registrierten medizinischen Produkte erhältlich.
- Für das nicht registrierte Produkt liegen Nachweise hinsichtlich Wirksamkeit und Sicherheit vor.
SAP ist auf Arzneimittel und Gesundheitsprodukte beschränkt. Medizinprodukte oder Veterinärprodukte sind nicht abgedeckt.
Aufgaben und Rollen
Die SFDA
- Nimmt SAP-Anfragen von behandelnden Ärzten oder Sponsoren entgegen und prüft sie.
- Abhängig von der Bewertung kann die SFDA dem Antrag stattgeben, zusätzliche Daten anfordern oder eine Ablehnung aussprechen.
- Erteilt Einfuhrgenehmigungen für zugelassene Arzneimittel, stellt die legale Einfuhr sicher und benachrichtigt die zuständigen Behörden.
- Wichtig ist, dass die SFDA die Sicherheit oder Wirksamkeit des Arzneimittels nicht umfassend bewertet ; diese Verantwortung liegt beim behandelnden Arzt .
Behandelnder Arzt
- Initiiert die SAP-Anforderung, wenn keine geeigneten Alternativen vorhanden sind.
- Der Arzt muss außerdem ausführliche Unterlagen wie die Anamnese, das Behandlungsprotokoll und den Überwachungsplan vorlegen.
- Der behandelnde Arzt muss gemäß den ICH-Richtlinien die Einwilligung des Patienten oder Erziehungsberechtigten einholen.
- Meldet alle unerwünschten Ereignisse und legt gegenüber der SFDA und dem Sponsor Rechenschaft über die Produktverwendung ab.
- Ärzte müssen unerwünschte Ereignisse gemäß den Anforderungen der Pharmakovigilanz und des QPPV melden.
Sponsor/Hersteller
- Der Sponsor stellt wichtige Produktdokumente bereit, darunter die Prüferbroschüre und Verschreibungsinformationen.
- Stellt die Einhaltung der Exportgesetze des eigenen Landes sicher.
- Der Sponsor kann den SAP-Antrag auch direkt einreichen, wenn er am Verfahren teilnimmt.
- Als letzte Verantwortung muss der Sponsor sicherstellen, dass alle SAP-bezogenen Dokumente vollständig und richtig sind und den SFDA-Vorschriften entsprechen.
SAP-Anwendungspfad
Manchmal kann ein zugelassener behandelnder Arzt oder der Sponsor/Hersteller den SAP-Antrag einreichen. Wenn kein Sponsor beteiligt ist, kann der behandelnde Arzt den SAP-Antrag allein einreichen.
Voraussetzungen für die Vorabgenehmigung
Um den Antrag einzuleiten, müssen diese Dokumente an den Executive Vice President for Drug Affairs der SFDA gesendet werden:
- Unterschriebenes Anschreiben mit arabischem Kopf (offizielle Adresse) .
- SAP-Protokoll , das Folgendes enthalten muss:
- Begründung für die Verwendung des Prüfpräparats.
- Zusammenfassung des Zustands des Patienten, der Krankengeschichte und früherer Behandlungsversuche.
- Dosierung, Verabreichungsmethode und Dauer der Therapie.
- Methoden zur Überwachung und Sicherheitsbewertung.
- Zusätzliche Produktdokumentation (z. B. ausländische Verschreibungsinformationen).
- Ermittlerbroschüre mit Einzelheiten:
- Formulierung und Struktur von Arzneimitteln.
- Pharmakologische und toxikologische Daten.
- Ergebnisse klinischer Studien, die für die Sicherheit und Wirksamkeit relevant sind.
- Bekannte Risiken, Nebenwirkungen und notwendige Vorsichtsmaßnahmen.
- Einverständniserklärung , die:
- Machen Sie deutlich, dass die Teilnahme des Patienten an SAP freiwillig ist.
- Beschreiben Sie die Dauer und Ziele des Programms.
- Beschreiben Sie Verfahren, Risiken und potenzielle Vorteile.
- Fügen Sie Kontaktinformationen hinzu, damit Patienten Fragen stellen oder unerwünschte Ereignisse melden können.
Sponsoren ausgewiesener oder außergewöhnlicher Produkte sollten beschleunigte Optionen prüfen, wie etwa die Einstufung als Orphan Drug oder Breakthrough Designation .
Anforderungen nach der Genehmigung
Nach der Genehmigung muss der Arzt die folgenden Dokumente zur Produktfreigabe einreichen.
- Offizielles Anschreiben mit arabischer Überschrift von der begünstigten Institution.
- Vom Arzt ausgefülltes und unterschriebenes SAP-Anforderungsformular .
- Kopie der unterzeichneten Einverständniserklärung (des Patienten oder Erziehungsberechtigten) gemäß den ICH-Anforderungen.
- Alle zusätzlichen von der SFDA angeforderten Dokumente.
SAP-Anforderungsworkflow
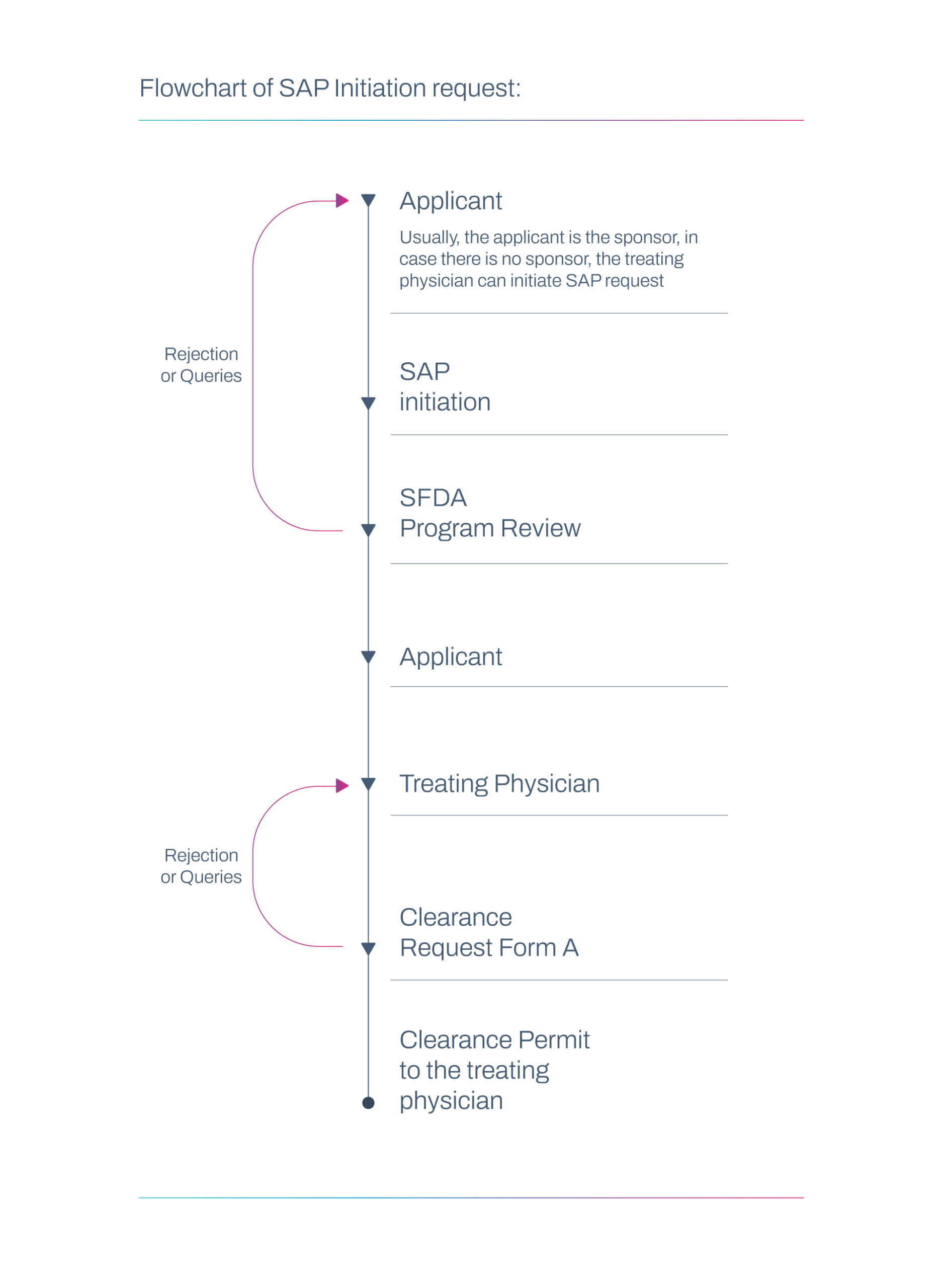
Meldepflichten
Sicherheitsberichterstattung
- SUSARs müssen mithilfe des CIOMS-Formulars (Council for International Organizations of Medical Sciences) gemeldet und vom Antragsteller im XML-Format eingereicht werden. Behandelnde Ärzte können jedoch von der XML-Einreichungspflicht befreit werden.
- Tödliche/lebensbedrohliche SUSARs: innerhalb von 7 Tagen
- Andere SUSARs: innerhalb von 15 Tagen
Fortschrittsberichte
- Reichen Sie alle drei Monate oder auf Anfrage der SFDA Statusberichte ein.
- Die Berichte sollten insbesondere Folgendes enthalten:
- Protokollabweichungen
- Zusätzliche Risiken oder Sicherheitsbedenken
- Schwerwiegende unerwünschte Arzneimittelwirkungen (UAW)
- Neue Sicherheitsinformationen
Produktfreigabe
Nach der Genehmigung durch die SFDA erhält der Sponsor oder das Krankenhaus einen Importbrief, um das Produkt durch den saudischen Zoll zu bringen.“
Wichtige Compliance-Hinweise
- Insbesondere ist die Werbung oder Verkaufsförderung von Produkten unter SAP strengstens untersagt.
- SAP ist nur für die Verwendung durch benannte Patienten bestimmt und ist kein Ersatz für formelle klinische Studien oder Verfahren zur Marktzulassung.
- Für Gen- oder Zelltherapien reicht die SAP-Zulassung allein möglicherweise nicht aus. Sponsoren müssen die CAR-T / ATMP -Rahmenwerke der SFDA zu spezifischen Klassifizierungs-, GMP- und Datenanforderungen konsultieren.
Registrierungsunterstützung
Bei PharmaKnowl Consulting sind wir auf regulatorische Beratungsleistungen spezialisiert, die auf die SFDA-Richtlinien zugeschnitten sind. Unsere Experten bieten strategische Beratung zu Anfragen im Rahmen des Special Access Program (SAP), von der Eignungsprüfung über die Dokumentationsplanung bis hin zur Sicherstellung der Übereinstimmung mit den SFDA-Anforderungen.
Nehmen Sie noch heute Kontakt mit PharmaKnowl auf, um Ihre SAP-Reise zu optimieren.



