
Sobre o autor
Regulatory Editor
Published by regulatory affairs team in PharmaKnowl, Riyadh office.
SFDA exige que todas as empresas de dispositivos médicos na Arábia Saudita cumpram os regulamentos de Identificação Única de Dispositivos (UDI). Elas devem registrar as informações de UDI de seus produtos no sistema de UDI SFDA . Os regulamentos são aplicados gradualmente com base na classe de risco do dispositivo e só podem ser enviados por meio de representantes autorizados na Arábia Saudita.
Índice
O que é UDI?
Identificação Única de Dispositivo (UDI) é uma série de caracteres numéricos ou alfanuméricos gerados por meio de um sistema de codificação globalmente aceito. É um identificador que identifica um dispositivo de forma inequívoca por meio de sua distribuição e uso. Composto por duas partes:
1. Um Identificador de Dispositivo (DI): uma parte obrigatória e fixa de um UDI que identifica o Número de Produto específico de um dispositivo e o rotulador desse dispositivo e
2. Um Identificador de Produção (PI): uma parte condicional e variável de um UDI que identifica um ou mais dos seguintes itens quando incluídos no rótulo do dispositivo:
- Lote ou lote no qual um dispositivo foi fabricado.
- O número de série de um dispositivo específico.
- A data de validade de um dispositivo específico.
- A data de fabricação de um dispositivo específico.
A UDI deve ser colocada no rótulo do dispositivo e nos níveis superiores dos materiais de embalagem e ser apresentada em duas formas:
- Texto simples de fácil leitura (também conhecido como HRI – Interpretação Legível por Humanos) e
- Tecnologia AIDC (Identificação Automática e Captura de Dados).
Código de barras UDI – O que está no rótulo?
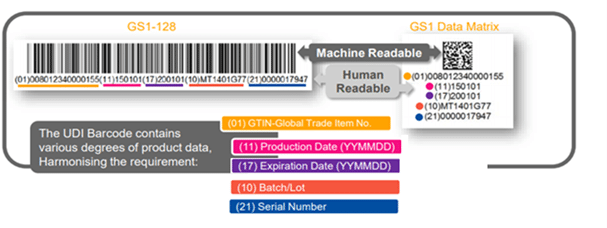
Escopo
- Todos os dispositivos médicos e seus acessórios, exceto aqueles feitos sob medida para pacientes específicos e dispositivos para uso em investigação e pesquisa
- Fabricantes, representantes autorizados
Agências Emissoras Reconhecidas
As agências emissoras reconhecidas pela UDI são as seguintes entidades: GS1, HIBCC e ICCBBA.
Banco de dados UDI
- O fabricante ou seu representante autorizado deve enviar e manter os dados apropriados no banco de dados UDI.
- Deve ser verificado e mantido periodicamente pelo fabricante
- Os dados do novo UDI-DI estarão disponíveis no banco de dados quando o dispositivo for colocado no mercado.
- Todos os dados especificados (não privados) no banco de dados estarão disponíveis publicamente.
- Todos os dados em GHAD e Saudi-DI, como nome do modelo e código GMDN, são precisos e válidos.
POR QUE UDI?
O Sistema UDI da SFDA visa padronizar a identificação de dispositivos médicos (e seus acessórios). O sistema UDI busca aumentar a segurança do paciente e otimizar o atendimento ao paciente, facilitando o seguinte:
Aumentando a segurança do paciente
- Aumentar a segurança do paciente: em relatórios de eventos adversos e outras atividades de vigilância pós-comercialização, ações corretivas de segurança em campo.
- Melhorando a identificação e a rastreabilidade: Controle nos portos e durante seus ciclos de vida, identificação e documentação no ponto de uso do paciente.
- Identificação de falsificações.
- Uso seguro e eficaz de dispositivos e redução de erros médicos.
- Registros eletrônicos de saúde do paciente.
Utilizado em outros aspectos
- Gestão de compras e estoque
- Atividades de seguro médico
- Controle e monitoramento de custos
- Substituir a codificação interna por UDI
Datas de vigência
- Em vigor a partir de 1º de outubro de 2020
Iniciando o banco de dados UDI e iniciando o registro opcional para todos os tipos de dispositivos. - O plano de execução será baseado na classe de risco do produto da seguinte forma:
- Alto Risco (D): 1 de setembro de 2023
- Risco Médio (B, C): 1 de setembro de 2023
- Baixo Risco (Classe A): 1 de setembro de 2024

Quem pode registrar o UDI?
Somente representantes autorizados pela Arábia Saudita podem acessar a plataforma SFDA UDI. Entre em contato conosco para obter suporte.
Leia mais:



