
Sobre o autor
Krishna Sravya
Regulatory Affairs Specialist (M.Pharm) at PharmaKnowl, focused on SFDA compliance and intelligence for Pharma and MedTech.
O Programa de Acesso Especial (SAP), introduzido pela Autoridade Saudita de Alimentos e Medicamentos (SFDA), permite que pacientes tenham acesso a medicamentos não registrados em casos urgentes ou com risco de vida. O programa garante que pacientes com necessidades médicas não atendidas possam ter acesso ao tratamento, mesmo que a aprovação do medicamento ainda não tenha sido concedida na Arábia Saudita.
Índice
Introdução ao SAP
Pacientes individuais que atendam a determinadas condições de elegibilidade podem utilizar medicamentos, produtos biológicos e itens médicos não registrados no SAP. O programa se aplica apenas a problemas médicos muito especiais e somente em casos em que:
- O paciente sofre de uma condição grave ou com risco de vida.
- Não há produtos médicos registrados alternativos disponíveis localmente.
- O produto não registrado demonstrou evidências de eficácia e segurança.
O SAP se limita a produtos farmacêuticos e de saúde. Não abrange dispositivos médicos ou produtos veterinários.
Deveres e Funções
A SFDA
- Recebe e analisa solicitações SAP enviadas por médicos ou patrocinadores.
- Dependendo da avaliação, o SFDA pode aprovar a solicitação, solicitar dados adicionais ou emitir uma rejeição.
- Emite licenças de importação para medicamentos aprovados, garantindo a importação legal e notificando as autoridades relevantes.
- É importante ressaltar que a SFDA não avalia de forma abrangente a segurança ou eficácia do medicamento; essa responsabilidade é do médico responsável pelo tratamento .
Médico assistente
- Inicia a solicitação SAP na ausência de alternativas adequadas.
- O médico também deve enviar documentos detalhados, como histórico médico, protocolo de tratamento e plano de monitoramento.
- O médico responsável deve obter o consentimento informado do paciente ou responsável, conforme as diretrizes do ICH.
- Relata todos os eventos adversos e fornece responsabilidade pelo uso do produto à SFDA e ao patrocinador.
- Os médicos devem relatar eventos adversos em conformidade com os requisitos de Farmacovigilância e QPPV .
Patrocinador/Fabricante
- O patrocinador fornece os principais documentos do produto, incluindo o folheto do investigador e informações de prescrição.
- Garante a conformidade com as leis de exportação do seu próprio país.
- O patrocinador também pode enviar a solicitação SAP diretamente se estiver participando do processo.
- Como responsabilidade final, o Patrocinador deve garantir que todos os documentos relacionados ao SAP estejam completos, precisos e em conformidade com os regulamentos da SFDA.
Caminho do aplicativo SAP
Às vezes, um médico assistente licenciado ou o patrocinador/fabricante pode enviar a solicitação SAP. Quando não há patrocinador envolvido, o médico responsável pelo tratamento pode enviar a solicitação SAP sozinho.
Requisitos de pré-aprovação
Para iniciar a solicitação, estes documentos devem ser enviados ao Vice-Presidente Executivo de Assuntos de Drogas da SFDA:
- Carta de apresentação assinada em árabe (endereçada oficialmente) .
- Protocolo SAP , que deve incluir:
- Justificativa para o uso do medicamento experimental.
- Resumo da condição do paciente, histórico médico e tentativas de tratamento anteriores.
- Dosagem, método de administração e duração da terapia.
- Métodos de monitoramento e avaliação de segurança.
- Documentação adicional do produto (por exemplo, informações de prescrição estrangeiras).
- Brochura do Investigador , detalhando:
- Formulação e estrutura do medicamento.
- Dados farmacológicos e toxicológicos.
- Resultados de ensaios clínicos relevantes para segurança e eficácia.
- Riscos conhecidos, efeitos colaterais e precauções necessárias.
- Termo de Consentimento Informado , que deve:
- Declare claramente que o paciente está participando do SAP de forma voluntária.
- Descreva a duração e os objetivos do programa.
- Descreva procedimentos, riscos e benefícios potenciais.
- Inclua informações de contato para que os pacientes possam fazer perguntas ou relatar eventos adversos.
Os patrocinadores de produtos designados ou excepcionais devem explorar opções mais rápidas, como a designação de medicamento órfão ou de inovação.
Requisitos pós-aprovação
Após a aprovação, o médico deve enviar os seguintes documentos para liberação do produto.
- Carta de apresentação oficial em árabe da instituição beneficiária.
- Formulário de solicitação SAP preenchido e assinado pelo médico .
- Cópia do Consentimento Informado Assinado (pelo paciente ou responsável legal) conforme os requisitos do ICH.
- Quaisquer documentos adicionais solicitados pela SFDA.
Fluxo de trabalho de solicitação SAP
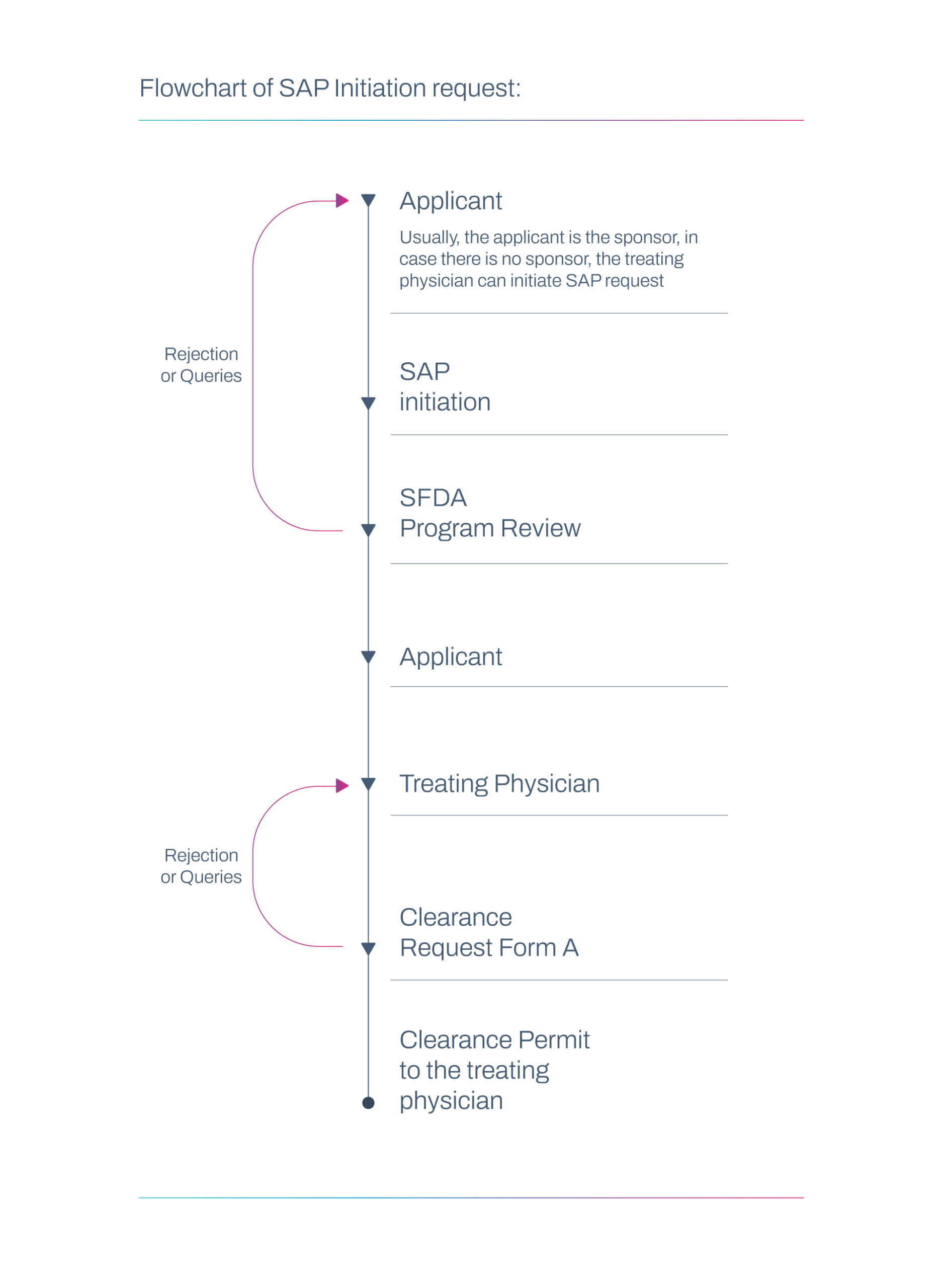
Obrigações de Relatório
Relatórios de Segurança
- Os SUSARs devem ser relatados usando o Formulário CIOMS (Conselho para Organizações Internacionais de Ciências Médicas) e enviados pelo requerente em formato XML. No entanto, os médicos responsáveis pelo tratamento podem estar isentos da exigência de envio em XML.
- SUSARs fatais/com risco de vida: dentro de 7 dias
- Outros SUSARs: dentro de 15 dias
Relatório de progresso
- Envie relatórios de status a cada 3 meses ou conforme solicitado pelo SFDA.
- Em particular, os relatórios devem incluir:
- Desvios de protocolo
- Riscos adicionais ou preocupações de segurança
- Reações adversas graves a medicamentos (RAMs)
- Informações de segurança emergentes
Liquidação de produtos
Após a aprovação da SFDA, o patrocinador ou hospital recebe uma carta de importação para liberar o produto na alfândega saudita.”
Notas importantes de conformidade
- Vale ressaltar que é estritamente proibido anunciar ou promover produtos sob a SAP.
- O SAP é para uso exclusivo de pacientes indicados e não substitui ensaios clínicos formais ou vias de autorização de comercialização.
- Para terapias genéticas ou celulares, a aprovação do SAP por si só pode não ser suficiente. Os patrocinadores devem consultar as estruturas CAR-T / ATMP da SFDA para requisitos específicos de classificação, BPF e dados.
Suporte de Registro
Na PharmaKnowl Consulting, somos especializados em serviços de consultoria regulatória adaptados aos requisitos da SFDA. Nossos especialistas fornecem orientação estratégica para solicitações do Programa de Acesso Especial (SAP), desde a avaliação de elegibilidade até o planejamento da documentação, garantindo o alinhamento com os requisitos da SFDA.
Entre em contato com a PharmaKnowl hoje mesmo para otimizar sua jornada SAP.



