In the realm of pharmaceutical innovation, breakthrough medicines stand as transformative agents, promising novel solutions to address critical medical needs. The Saudi Food and Drug Authority (SFDA) recognizes the significance of these groundbreaking therapies. It established a particular designation for drug registration applications to facilitate their development and expedite regulatory approval. Let’s delve into the critical aspects of the SFDA’s approach to breakthrough medicines.
Table of contents
Defining Breakthrough Medicines
Breakthrough medicines represent a paradigm shift in the treatment landscape, offering substantial advantages over existing therapies for severe or life-threatening conditions. These medicines demonstrate a significant improvement in efficacy or safety compared to available treatments, potentially altering the course of patient care.
The SFDA’s commitment to advancing public health is evident in its proactive stance towards breakthrough medicines. By recognizing the unique challenges and opportunities associated with these transformative therapies, the SFDA aims to streamline its development and regulatory approval processes.
Criteria for Breakthrough Designation
To qualify for the breakthrough designation, a drug must meet specific criteria outlined by the SFDA below:
- Target serious, debilitating, or life-threatening conditions with unmet medical needs.
- The medicinal product is likely to offer a significant advantage over current methods.
- The benefits outweigh the potential adverse effects of the medicinal product, allowing for the reasonable expectation of a positive benefit/risk balance.
- The product is not registered with any stringent regulatory authority.
Collaborative Development Plans
The SFDA encourages open communication and collaboration between drug developers and regulatory authorities. This collaborative approach involves creating development plans that outline key milestones and ensure transparency and alignment among all stakeholders.
Regulatory Requirements
The SFDA exercises flexibility in regulatory requirements for breakthrough medicines while maintaining a robust scientific evaluation. If any of the registration requirements (e.g., CPP, leaflet, and artwork) are unavailable, the applicant may request an exemption.
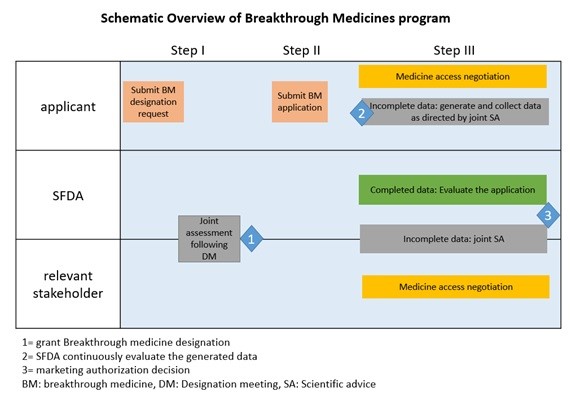
Post-Market Monitoring
Even after regulatory approval, the SFDA continues to monitor breakthrough medicines post-market actively. This ongoing surveillance ensures the ongoing safety and efficacy of these therapies and promptly addresses any emerging concerns.
Impact on Patient Care
The SFDA’s commitment to breakthrough medicines profoundly impacts patient care in Saudi Arabia. By expediting the development and approval of transformative therapies, the SFDA contributes to the availability of cutting-edge treatments, offering new hope to patients facing severe or life-threatening conditions.
Conclusion
In embracing the era of breakthrough medicines, the SFDA positions itself as a facilitator of innovation and a guardian of public health. The guidelines for breakthrough designation not only encourage the development of transformative therapies but also exemplify the SFDA’s dedication to ensuring that these advancements reach patients promptly and responsibly.
As the landscape of medical innovation continues to evolve, the SFDA’s commitment to breakthrough medicines remains steadfast. It promises a future in which groundbreaking therapies become more accessible.
Read More
About the Author
Regulatory Affairs Specialist, experienced in pharmaceutical regulatory activities, including product registration, renewals, and variations. Skilled in preparing and managing regulatory submissions & pathways such as Orphan Drug Designation (ODD), Breakthrough Therapy, and Priority Review.
Resources
Services
Events







